Playlist
Show Playlist
Hide Playlist
Michaelis-Menten Kinetics – Enzyme Catalysis
-
01 Advanced Enzymes&Kinetics1.pdf
-
Reference List Biochemistry.pdf
-
Download Lecture Overview
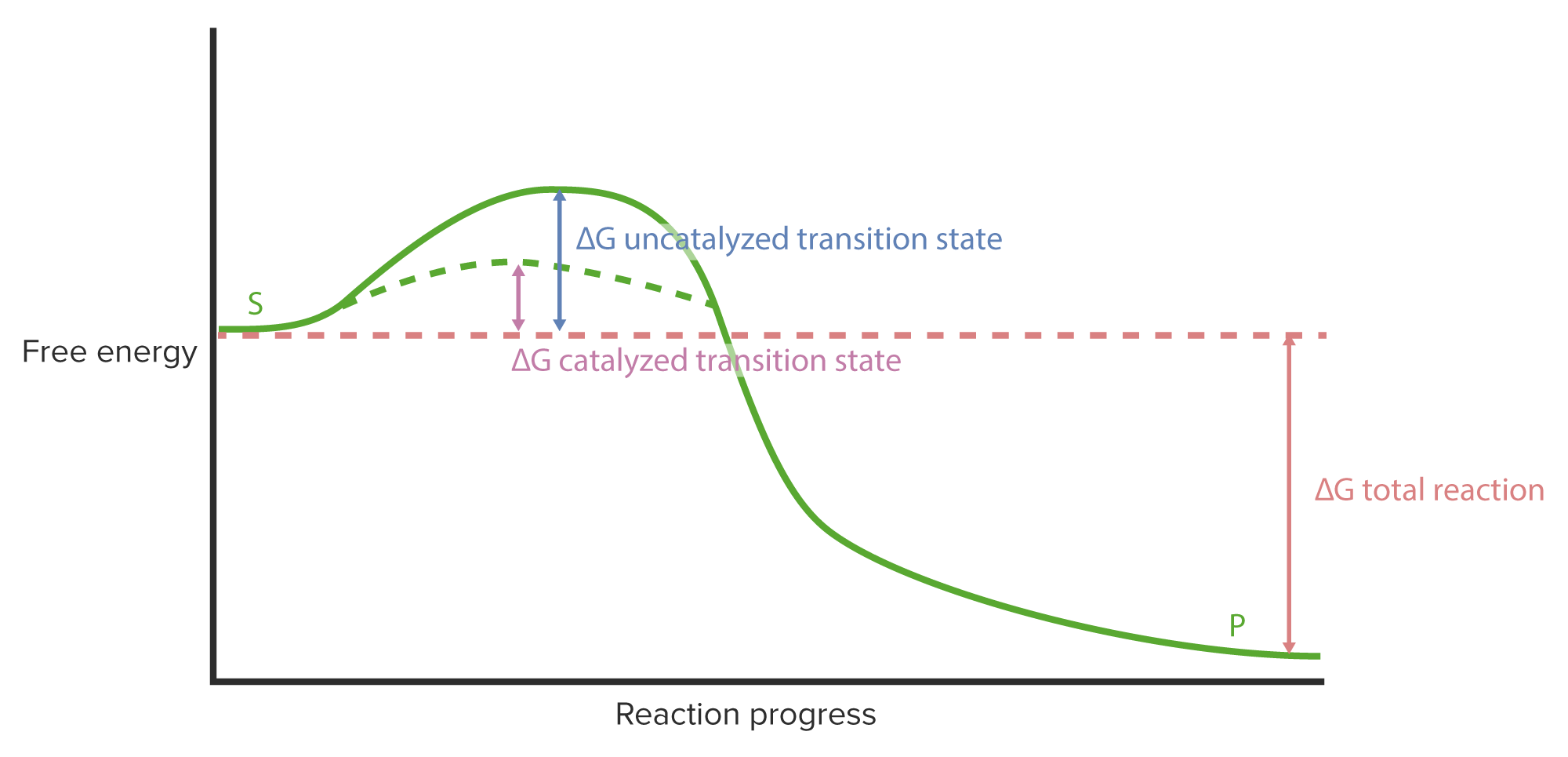
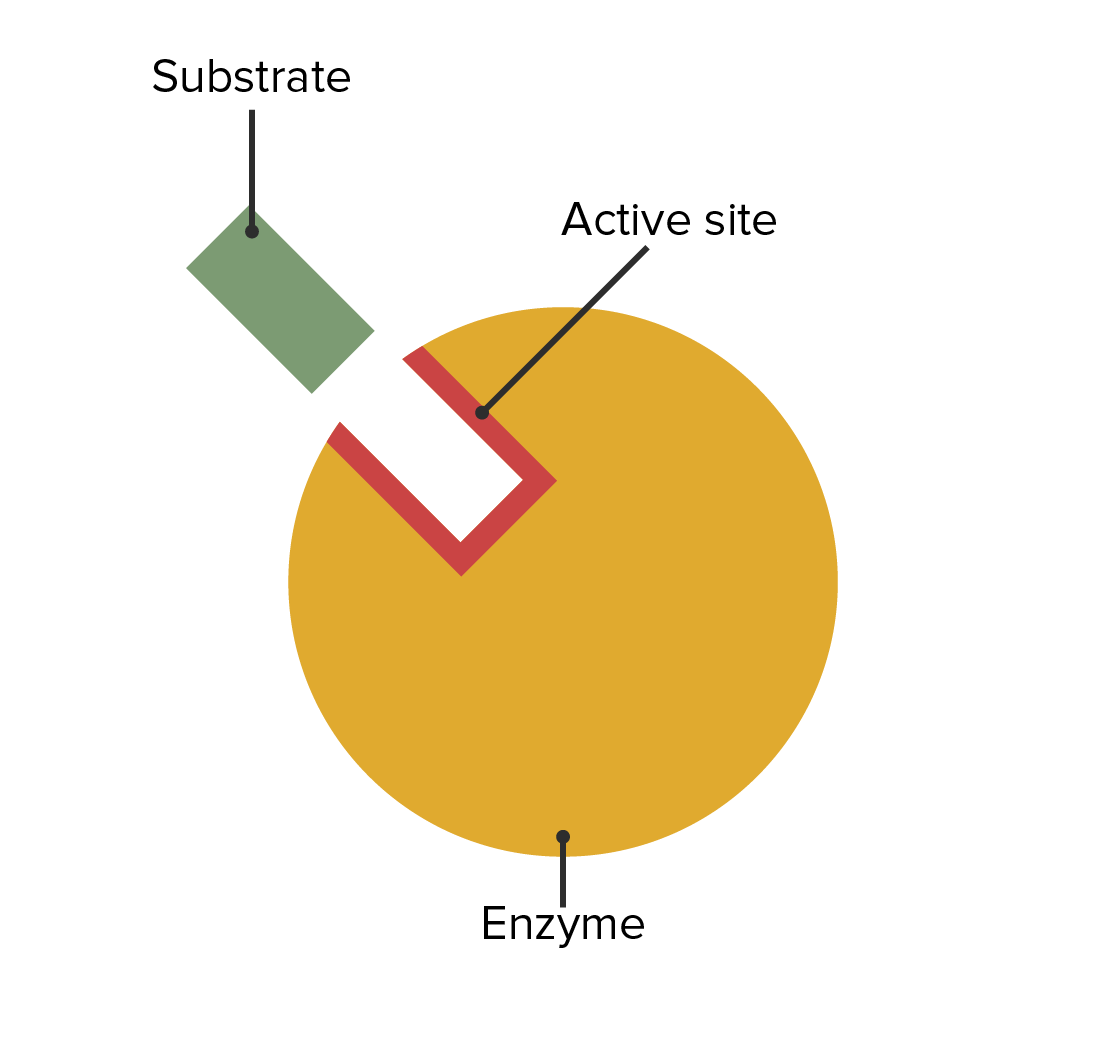
00:01 Das wird jetzt etwas kompliziert, daher möchte ich es Ihnen Schritt für Schritt erklären. Diese Aspekte der Durchführung von Reaktionen heißen Michaelis-Menten-Kinetik. 00:08 Wir sehen auf der y-Achse wieder die Konzentration und auf der x-Achse die Zeit. 00:14 Und vorher haben wir einfach die Anhäufung von Produkt gesehen, wie das orangefarbene Symbol hier zeigt. 00:23 Nun, wie sehen die Umstände am Anfang einer Reaktion aus? Wir haben vier verschiedene Dinge, die gemessen werden können. Wir haben die Substratkonzentration. 00:33 Wir haben die Enzymkonzentration. Wir haben die Konzentration des Enzym-Substrat-Komplexes, und letztendlich werden wir die Produktkonzentration erhalten, und diese wollen wir untersuchen, okay? Zu Beginn ist die Produktkonzentration niedrig, wie Sie sehen können. 00:47 Und das ist nicht überraschend, denn die Reaktion hatte noch keine Gelegenheit, überhaupt anzufangen. 00:53 Die Konzentration von ES ist niedrig, weil das Substrat bisher keine Gelegenheit hatte, mit dem Enzym in Kontakt zu kommen. 00:59 Die Konzentration von freiem Enzym, d.h. Enzym, das nicht an ein Substrat gebunden ist, ist relativ hoch. Sie sehen, es kommt von der y-Achse herunter. 01:07 Und schließlich die Substratkonzentration: Sie ist hoch, weil bisher noch kein Substrat reagiert hat. 01:13 Zum Zeitpunkt 0 liegen also diese Bedingungen vor. Und diese Umstände erweisen sich als nicht ideal, um die enzymatische Reaktion messen zu können. Während die Reaktion abläuft, sehen wir Veränderungen dieser Größen. 01:26 Wir sehen zunächst, dass die Substratkonzentration zum Ende der Reaktion niedrig ist und während des gesamten Prozesses gefallen ist. 01:33 Die Konzentration des ES-Komplexes, die zu Beginn bei 0 lag, ist gestiegen und wir werden sehen, dass dass sie sich irgendwann einpendeln wird. 01:42 Wir sehen auch, dass die zum Beginn recht hohe Konzentration von freiem Enzym fällt, und auch sie wird sich mit der Zeit einpendeln. Und schließlich sehen wir natürlich, dass die Produktkonzentration am Anfang niedrig ist und bis zum Ende ansteigt. 01:55 Nun, ich zeige Ihnen dieses Diagramm nicht um das Bild zu sehr zu verkomplizieren - hoffentlich -, sondern um zu demonstrieren, was wir tatsächlich bei der Untersuchung enzymatischer Reaktionen getan haben. 02:07 In der allerersten Phase - ich hoffe, dass ich Ihnen dies überzeugend dargelegt habe - befinden wir uns in einer Art Vor-"steady state". Ich werde gleich erklären, was "steady state" (Fließgleichgewicht) bedeutet, aber wir zunächst liegen Bedingungen vor, unter denen die Reaktion noch keine Gelegenheit hatte, zu beginnen. 02:19 Das Enzym arbeitet noch nicht, aber dann verändert sich alles ziemlich schnell: die Substratkonzentration, die Enzymkonzentration, die Konzentrationen von Enzym-Substrat-Komplex und Produkt. 02:31 Solche Reaktionen sind ganz schön variabel. Ich habe gesagt, wir wollen die Anfangsgeschwindigkeit untersuchen, aber wir müssen vorsichtig sein. Wenn wir einen zu frühen Zeitpunkt auswählen, bekommen wir vielleicht nicht das, was wir wollen. 02:42 Es ist also wichtig, die Reaktion zu einem Zeitpunkt zu betrachten bei dem sich die Dinge quasi eingependelt haben. 02:49 Unter den Bedingungen des Steady State (Fließgleichgewichts) gleichen sich diese Größen, die sich anfangs ziemlich schnell verändert hatten, aus. Das ist für unsere Überlegungen sehr wichtig. 03:03 Wir können also zum Beispiel sehen, dass sich in der Initialphase die Konzentrationen des freien Enzyms und des ES-Komplexes ändern: Die Konzentration von E sinkt sehr schnell und die Konzentration von ES steigt sehr schnell an. 03:16 Unter Steady State-Bedingungen, wie wir hier sehen können, haben sie zunehmend ein Plateau erreicht. 03:21 Es ist kein wirkliches Plateau, aber zumindest viel mehr als vor dem Steady State. 03:27 Das erweist sich für uns als wichtig, denn wir wollen Umwandlung des Enzym-Substrat-Komplexes in ein Produkt untersuchen. Wenn wir also eine relativ konstante Konzentration des Enzym-Substrat-Komplexes haben, geschieht der Zerfall bzw. die Umwandlung in ein Produkt, mit einer relativ konstanten Geschwindigkeit. 03:49 Genau da wollen wir hin. Und deshalb ist es wichtig für uns, diese Reaktionen unter Steady-State-Bedingungen zu untersuchen. 03:53 Steady-State-Bedingungen: das heißt, dass sich diese Größen nicht signifikant verändern. 03:59 Jetzt können wir sehen, was hier insgesamt passiert. Zum Zeitpunkt des Steady State messen wir, und wir sehen, dass dieser relativ lineare Abschnitt der Kurven der freien Enzymkonzentration und der ES-Komplex-Konzentration unter diesen Bedingungen geschieht, während wir die enzymatische Reaktion messen. 04:20 In dieser Präsentation haben wir einige Details darüber betrachtet, wie Enzyme mit dem Substrat interagieren, wie Enzyme Energie manipulieren können, damit alles so abläuft, wie sie wollen, und wie Enzyme auf der Ebene der Elektronen ihre Aufgabe erfüllen können. Und wir haben auch etwas gelernt über die Art und Weise, wie wir die Kinetik oder die Geschwindigkeit von Reaktionen untersuchen. In einer anderen Präsentation werden wir dies zusammensetzen bzw. diese Informationen verwenden, um einige Besonderheiten der Enzymkinetik zu betrachten.
About the Lecture
The lecture Michaelis-Menten Kinetics – Enzyme Catalysis by Kevin Ahern, PhD is from the course Enzymes and Enzyme Kinetics.
Included Quiz Questions
When is the formation of the product during an enzymatic reaction usually measured?
- Steady-state reaction condition
- High product concentration condition
- High enzyme concentration condition
- Low product concentration condition
- Low substrate concentration condition
Customer reviews
5,0 of 5 stars
| 5 Stars |
|
5 |
| 4 Stars |
|
0 |
| 3 Stars |
|
0 |
| 2 Stars |
|
0 |
| 1 Star |
|
0 |