Playlist
Show Playlist
Hide Playlist
Electron Carriers – Oxidation and Reduction in Metabolism
-
13 Basic PrinciplesOfMetabolism1.pdf
-
Biochemistry Free and Easy.pdf
-
Reference List Biochemistry.pdf
-
Download Lecture Overview
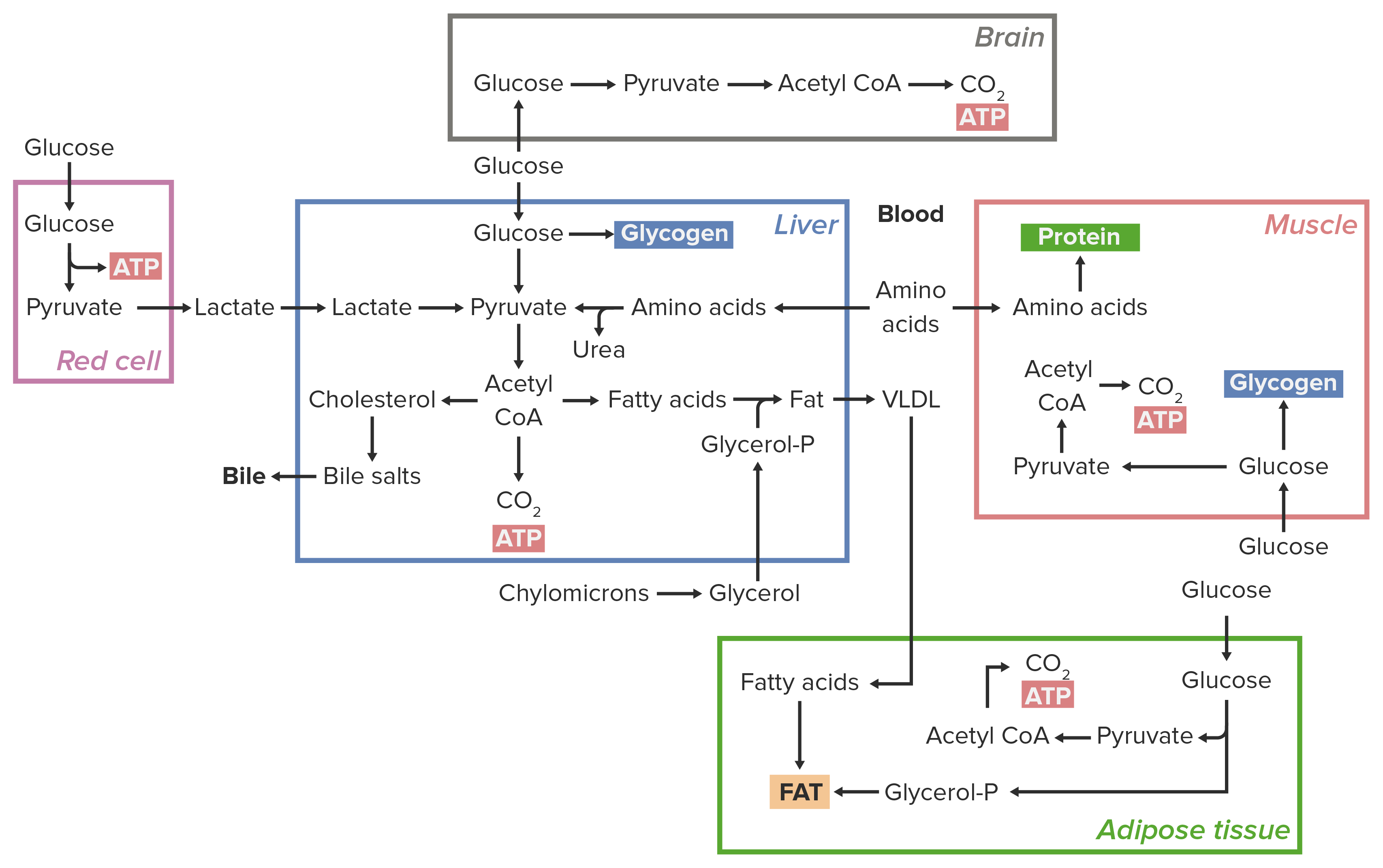
00:01 was sie mit Elektronenträgern tun. Das sind nun Moleküle, die die Fähigkeit haben, die Elektronen zu absorbieren und in diesem Fall auch mindestens eines der Protonen, das in einem oxidativen Prozess freigesetzt wird. Also was Sie auf dem Bildschirm sehen, sind zwei verwandte Moleküle, NAD+ auf der linken und NADH auf der rechten Seite. Und der einzige Unterschied zwischen diesen befindet sich eigentlich in den Ringen der Struktur ganz oben, Sie können sie hier oben sehen. 00:27 Die oxidative Form von NAD ist links dargestellt und man kann sehen, dass die Ringstruktur drei Doppelbindungen hat. Die reduzierte Form von NAD wird NADH genannt, es hat ein Proton und auch zwei Elektronen gewonnen und das hat eine elektronische Umstrukturierung dieses Rings verursacht. Was passiert ist, ist, dass der Ring jetzt zwei Elektronen trägt, die er vorher nicht hatte und diese zwei Elektronen könnten aus einer Reaktion stammen, wie ich sie gerade gezeigt habe. 00:58 Eine andere Art von Elektronenüberträger (Reduktionsäquivalent), die wir in Zellen gesehen haben, ist FAD. FAD kann ähnlich wie NAD fungieren, und wenn FAD dies tut, absorbiert es zwei Protonen und zwei Elektronen und wird dabei zu FADH2. Und so können wir sehen, dass dies hier geschieht, wo wir die oxidierte Form auf der linken Seite haben und wir können das Verschwinden einer Doppelbindung zur Bildung der verkleinerte Form sehen, wie wir hier rechts beobachten können. Jetzt ist es wichtig zu wissen, dass diese Moleküle, wenn sie Elektronen aufnehmen, reduziert werden. 01:29 Hier ist also ein Beispiel für eine biologische Oxidation. Wir sehen die Reduktion von NAD zu NADH und der Grund, warum die Reduktion von von NAD zu NADH geschehen ist, ist, weil gleichzeitig die Oxidation der anderen Verbindung stattfindet. Oxidation und Reduktion sind gepaart. Wir sehen also, dass dies auf der linken Seite geschieht, wir haben ein Molekül, das Malat genannt wird. Malat hat einen Alkohol an Position zwei und dieser Alkohol wird im Molekül zu einem Keton auf der rechten Seite oxidiert. Das bedeutet auch den Verlust eines Elektronenpaares und diese Elektronen sind von NAD aufgenommen worden. Es gibt die reduzierte Form von Malat, und es gibt die oxidierte Form von NAD. 02:13 Wenn die Reaktion stattfindet, haben wir die oxidierte Form von Malat, die als Oxalacetat bekannt ist und die reduzierte Form von NAD, die als als NADH bekannt ist. Sie haben also die Positionen getauscht, weil die Elektronen ihre Position getauscht haben. 02:26 In diesem Sinne hoffe ich, dass Ihnen dies einen guten Einstieg in das Verständnis der Prozesse von Oxidation und Reduktion ermöglicht hat und wir werden in einer anderen Vorlesung sehen, wie diese Prozesse zusammen interagieren und die Kontrolle des Stoffwechsels ermöglichen.
About the Lecture
The lecture Electron Carriers – Oxidation and Reduction in Metabolism by Kevin Ahern, PhD is from the course Biochemistry: Basics.
Included Quiz Questions
Which of the following statement is NOT true regarding the electron carriers?
- In biological reactions, enzymes can transfer electrons from the reactants to the products in an energy-efficient way, without electron carriers.
- The electron carriers accept electrons and move them as part of the electron transport chain.
- The electron carriers are vital parts of cellular respiration and photosynthesis.
- Two common electron carriers in the cell are FAD and NAD+.
- In each redox reaction, the electron-donating molecules get oxidized, whereas the electron acceptors get reduced.
Customer reviews
5,0 of 5 stars
| 5 Stars |
|
1 |
| 4 Stars |
|
0 |
| 3 Stars |
|
0 |
| 2 Stars |
|
0 |
| 1 Star |
|
0 |
Dr. Ahern is amazing at linking what he's about to teach to previous videos.