Playlist
Show Playlist
Hide Playlist
Actions of the Second Messenger and Protein Kinase A
-
Slides HormonesSignalTransduction Biochemistry.pdf
-
Reference List Biochemistry.pdf
-
Download Lecture Overview
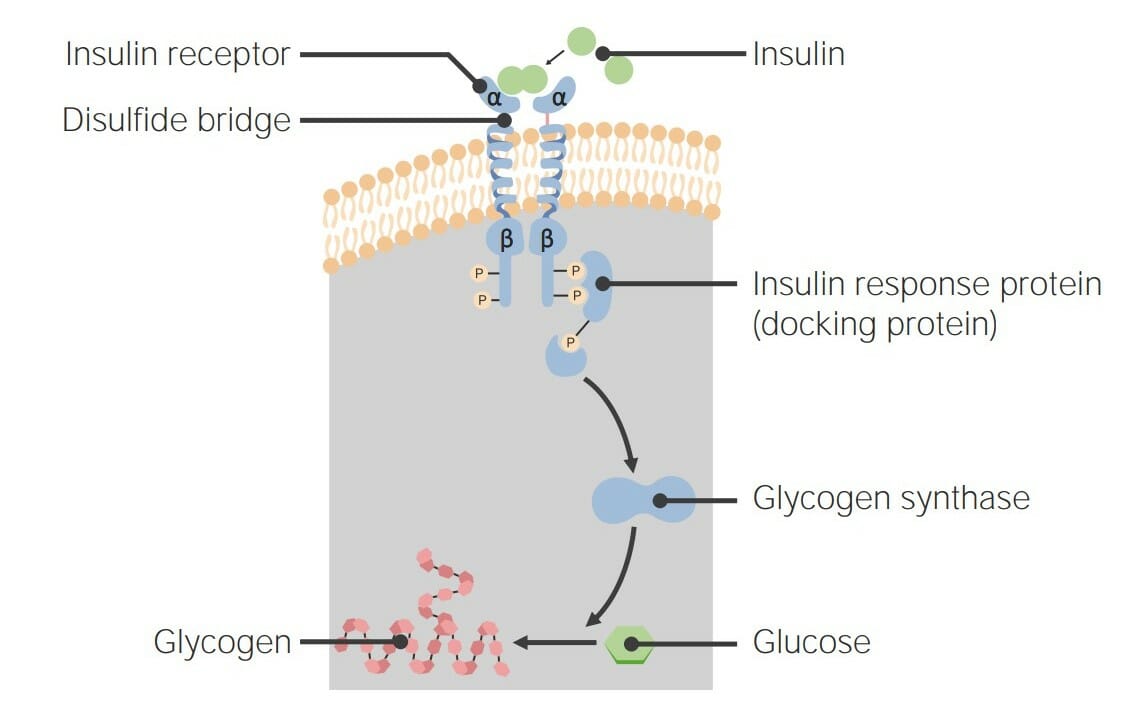
00:02 Das zyklische AMP als zweiter Botenstoff muss also mit anderen Molekülen interagieren, um das Signal zu übertragen, denn wenn es das nicht tut, dann gibt es kein Signal. 00:10 Es hat sich herausgestellt, dass zyklisches AMP mit einem Protein interagiert, das als Proteinkinase A bekannt ist. 00:17 Die Proteinkinase A ist, wie ihr Name schon sagt ein Protein und es ist auch ein Enzym. 00:23 Im Normalzustand ist die Proteinkinase A jedoch in der inaktiven Form, das heißt, sie katalysiert keine Reaktion. 00:30 Und das liegt daran, dass der katalytische Teil der Proteinkinase A verdeckt ist. 00:38 Das Abdecken des katalytischen Teils hindert den katalytische Teil daran, eine Reaktion zu katalysieren. 00:44 Das können wir also in dieser Darstellung hier sehen. 00:46 Wir sehen, dass die Proteinkinase A vier Untereinheiten hat, die mit ihr assoziiert sind. 00:50 Zwei Einheiten in Rot mit einem R darin, was anzeigt, dass es sich um regulatorische Untereinheiten handelt. 00:54 Und diese Untereinheiten decken die katalytische Stelle ab. 00:58 Die beiden C-Untereinheiten in blau sind da, Wo die katalytische Stelle sich befindet. 01:03 Hier kommen unsere vier Moleküle zyklisches AMP, die von der Adenylatzyklase in der vorangegangenen Reaktion produziert wurden. Diese vier zyklischen AMPs wandeln die inaktive Form der Proteinkinase A in die aktive Form um. Und das tun sie, indem sie an die regulatorischen Untereinheiten binden. Wie wir nun immer wieder in diesen Vorlesungen gesehen haben, verändert die Bindung eines Moleküls an ein Protein leicht die Form des Proteins, in diesem Fall die der regulatorischen Untereinheiten. Und die regulatorischen Untereinheiten können in ihrer veränderten Form nicht mehr an die katalytischen Untereinheiten binden. 01:38 Infolgedessen werden die katalytischen Untereinheiten freigesetzt und nun sind ihre katalytischen Stellen offen und zugänglich für alle Moleküle in der Zelle. 01:47 Sie können beginnen, Reaktionen zu katalysieren. 01:49 Wir sehen also, dass die Informationen des Hormons außerhalb der Zelle bis zur Proteinkinase A weitergegeben wurden. 01:57 Und wir haben noch einen weiten Weg vor uns. 02:00 Was die katalytischen Untereinheiten der Proteinkinase A tun ist, die Addition von Phosphaten an die Seitenketten von Serin und Threonin-Aminosäuren innerhalb eines Proteins zu katalysieren. 02:12 Dies ist die kovalente Modifikation, über die ich bereits gesprochen habe. 02:15 Wir können also sehen, dass diese Modifikation stattfindet, beginnend mit einem unphosphorylierten oder unmodifizierten Protein auf der linken Seite und dem modifizierten Protein auf der rechten Seite. 02:25 Das Phosphat, das an die Seitenketten von Serinen und Threoninen gehängt wird, stammt von einem ATP Molekül, das in einem Prozess, den wir Phosphorylierung nennen, auf die Seitenketten der Serine und Threonine übertragen wird. 02:41 Nun phosphoryliert die Proteinkinase A viele Proteine. 02:45 Und die Phosphorylierung dieser Proteine führt zu einer Änderung ihrer Aktivität. 02:50 Die Proteinkinase A phosphoryliert zum Beispiel Proteine im Glykogen-Stoffwechsel. 02:55 Zwei der Proteine, die es phosphoryliert, sind bekannt als Glykogensynthase, die die Bildung von Glykogen katalysiert. 03:02 Und ein weiteres Protein, bekannt als Phosphorylase- kinase oder PK, das den Glykogenabbau aktiviert. 03:11 Die Entscheidung der Zelle, entweder Glykogen herzustellen oder abzubauen, ist das Ergebnis der Wirkung dieses Hormonsystems, das ich hier beschrieben habe. 03:22 Schauen wir uns an, was was bei diesem Prozess passiert. 03:25 Hier ist die katalytische Untereinheit der Proteinkinase A, die im Prozess der vorherigen Folie freigesetzt wurde. 03:30 Wir sehen die Glykogensynthase mit der Markierung S und wir sehen, dass sie ein Phosphat gewinnt. 03:36 In diesem Schema, das ich Ihnen hier zeige sind die Enzyme, die aktiv sind grün dargestellt und die Enzyme, die inaktiv sind in rot dargestellt. 03:44 Wir sehen also in diesem Fall, dass die Glykogen Synthase zunächst in der aktiven Form vorlag, aber sie wurde mit einem Phosphat versehen und dadurch in die inaktive Form umgewandelt. 03:53 Aber die Proteinkinase A wirkt auch auf die Phosphorylase-Kinase, wie ich schon sagte. 03:58 Und die Phosphorylase-Kinase wird, wenn sie ein Phosphat gewinnt, von der inaktiven Form in rot, zur aktiven Form in grün umgewandelt. Die Phosphorylase-Kinase geht noch weiter und aktiviert den Abbau von Glykogen. Die Wirkung dieses Hormonsignalsystems besteht also darin, die Glykogensynthese abzuschalten und gleichzeitig den Glykogenabbau einzuschalten. Was die aktive Phosphorylase-Kinase tut, ist die Umwandlung eines Enzyms namens Glykogen- Phosphorylase von der inaktiven Form in die aktive Form, indem es ein Phosphat hinzufügt. Die Phosphorylase-Kinase ist also ein Protein, das einem anderen Protein ein Phosphat hinzufügen kann. Was die Glykogenphosphorylase a macht, die aktive Form, ist der Abbau von Glykogen. Und was die Glykogensynthase tut, wenn sie aktiv ist, ist die Bildung von Glykogen. Dieser Prozess, den ich Ihnen beschrieben habe, schaltet also, wie bereits gesagt, gleichzeitig die Glykogensynthese aus und den Glykogenabbau ein. Dieser Prozess, wie ich es in einer früheren Vorlesung beschrieben habe, ist als reziproke Regulation bekannt. Derselbe Prozess hat entgegengesetzte Auswirkungen auf katalytische -katabole und anabole- Wege.
About the Lecture
The lecture Actions of the Second Messenger and Protein Kinase A by Kevin Ahern, PhD is from the course Hormones and Signal Transduction. It contains the following chapters:
- Actions of the Second Messenger
- Protein Kinase A
Included Quiz Questions
Which statement regarding the regulation of glycogen metabolism is true?
- Glycogen synthase catalyzes glycogen formation.
- Phosphorylation activates all of the enzymes.
- Phosphorylation inactivates all of the enzymes.
- Glycogen synthesis and breakdown occur simultaneously.
What happens in the overview of the glycogen breakdown hormonal regulatory scheme? Select all that apply.
- The binding of epinephrine stops glycogen synthesis.
- When glycogen synthase is phosphorylated, it is active.
- When glycogen synthase is phosphorylated, it is inactive.
- The production of cAMP activates protein kinase A.
- The binding of epinephrine stimulates glycogen synthesis.
What does reciprocal regulation aim to do?
- Prevent the concurrent activity of 2 closely parallel metabolic pathways.
- Facilitate the concurrent activity of 2 closely parallel metabolic pathways.
- Prevent the concurrent inhibition of 2 separate metabolic pathways.
- Increase the rate of product formation.
- Decrease the rate of a reaction.
Which statements regarding protein kinase A (PKA) are true? Select all that apply.
- The phosphorylation of phosphorylase kinase enzyme by PKA leads to activation of glycogen breakdown.
- PKA is a structural protein essential for the maintenance of cell membrane morphology.
- The activated PKA enzyme inhibits glycogen synthesis by inactivating the glycogen synthase enzyme via the phosphorylation process.
- The activated PKA enzyme plays a crucial role in the reciprocal regulation of glycogen metabolism.
- Protein kinase A enzyme is composed of 4 subunits (2 regulatory and 2 catalytic).
Customer reviews
5,0 of 5 stars
| 5 Stars |
|
5 |
| 4 Stars |
|
0 |
| 3 Stars |
|
0 |
| 2 Stars |
|
0 |
| 1 Star |
|
0 |