O transplante é um procedimento que envolve a remoção de um órgão ou tecido vivo e a sua colocação numa parte diferente do organismo ou numa pessoa diferente. O transplante de órgão tornou-se numa opção terapêutica de escolha para muitos indivíduos com falência de órgãos em estadio terminal. Este pode oferecer ao indivíduo um tratamento definitivo para determinada doença. Ao longo da última metade de século, os transplantes de órgãos tornaram-se uma prática de sucesso e em evolução que trouxe benefício a mais MAIS Androgen Insensitivity Syndrome de 100.000 indivíduos por ano em todo o mundo. De acordo com as diferentes indicações, podem ser transplantados órgãos sólidos assim como células hematopoiéticas derivadas da medula óssea. A tolerância do órgão transplantado pelo sistema imunológico do hospedeiro é controlada pelo uso de estratégias imunossupressoras e imunomoduladoras. As principais complicações associadas ao transplante são a rejeição de órgão ou a falência do enxerto; no entanto, a imunossupressão crónica também está associada a risco de complicações graves, incluindo infeções potencialmente fatais.
Last updated: Dec 15, 2025
O tecido transplantado pode incluir células (e.g., células estaminais hematopoiéticas), tecidos (e.g., córnea), partes de um órgão (e.g., fígado e enxertos de pele) ou órgãos completos (e.g., rim, coração). Existem muitos termos importantes na medicina associada à transplantação.
A compatibilidade imunológica entre um dador e um recetor de órgãos é importante para aumentar o sucesso de um transplante e reduzir o risco de rejeição. A tipagem Antigénio Leucocitário Humano (HLA, pela sigla em inglês) é importante para o transplante de células estaminais hematopoiéticas e órgãos sólidos, incluindo transplantes de rim, coração, fígado, pâncreas e pulmão.
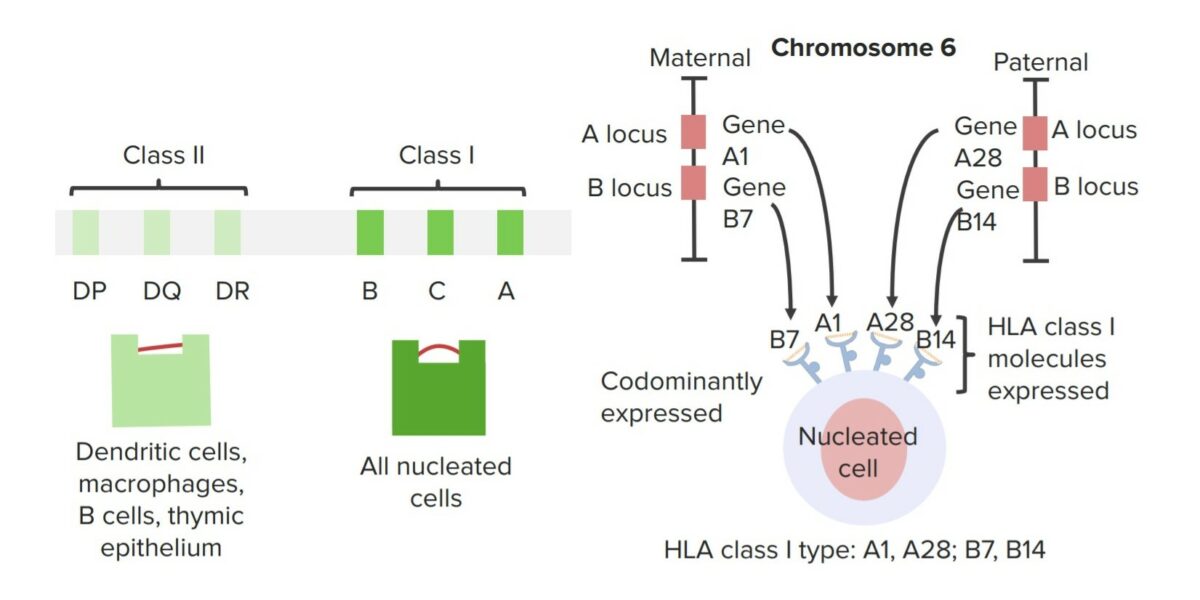
Complexo principal de histocompatibilidade
Imagem por Lecturio.A rejeição pode ser aguda ou crónica e os sintomas variam conforme o sistema orgânico.
| Rejeição | Tempo após o transplante | Características da rejeição |
|---|---|---|
| Hiperaguda | Em 48 horas |
|
| Acelerada | 3-5 dias |
|
| Aguda | > 5 dias |
|
| Crónica | Meses a anos |
|
Os indivíduos recetores de transplantes de órgãos sólidos devem fazer medicação imunossupressora para evitar a rejeição do enxerto. Os fármacos imunossupressores atuais apresentam como alvo a ativação de células T e a produção de citocinas, a expansão clonal de células T ou ambas.
A escassez de órgãos de dadores é um fator significativo no transplante hepático; muitos indivíduos morrem à espera de um órgão. Atualmente, realizam-se transplantes de dadores vivos, nos quais apenas uma parte do fígado é removida de um dador saudável.
Complicações:
Complicações da imunossupressão:
Imunizações para indivíduos pós-transplante/imunossuprimidos:
Rejeição:
Outras complicações:
O transplante cardíaco pode ser oferecido a indivíduos que apresentam sintomas intoleráveis apesar do tratamento médico otimizado e que apresentam risco de morte devido a doença cardíaca.