As síndromes mielodisplásicas (SMD) são um grupo de neoplasias clonais com defeitos de maturação caracterizadas por displasia, citopenia e precursores imaturos da medula óssea. As síndromes mielodisplásicas podem ser idiopáticas ou secundárias a várias exposições prejudiciais, como quimioterapia citotóxica, radiação ionizante ou toxinas ambientais. A idade média dos doentes é de 70 anos. A apresentação inclui sintomas de anemia (fadiga), neutropenia (infeção) ou trombocitopenia (hemorragia). O diagnóstico é baseado na avaliação da medula óssea, que revela citopenia, displasia em pelo menos 1 linhagem e células blásticas em < 20% da celularidade medular. São necessários estudos citogenéticos e moleculares para a classificação, prognóstico e decisões relacionadas com a terapêutica. Há um risco cumulativo aumentado de transformação em LMA, o qual varia dependendo do subtipo de SMD. O tratamento inclui cuidados de suporte, uso de fatores de crescimento hematopoiéticos, terapêutica imunossupressora e transplante alogénico de células hematopoiéticas.
Última atualização: Mar 8, 2025
As síndromes mielodisplásicas (SMD) são doenças clonais da medula óssea caracterizadas pela presença de precursores medulares displásicos imaturos e citopenias periféricas. A Organização Mundial de Saúde (OMS) publicou uma atualização em 2022, na qual passou a designar as síndromes mielodisplásicas por “neoplasias mielodisplásicas (SMD)”.
A maioria das SMD são atribuídas a deleções e translocações cromossómicas, ou mutações genéticas.
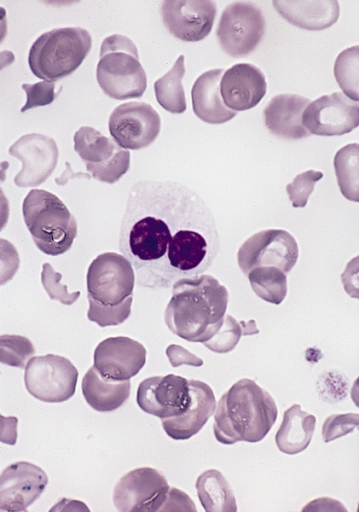
Esfregaço periférico na SMD a demostrar um neutrófilo displásico com núcleo bilobado e alteração da granulação (pseudo-alteração de Pelger-Huët)
Imagem: “Hypogranular neutrophil with a pseudo-Pelger-Huet nucleus in MDS” por The Armed Forces Institute of Pathology (AFIP). Licença: Public Domain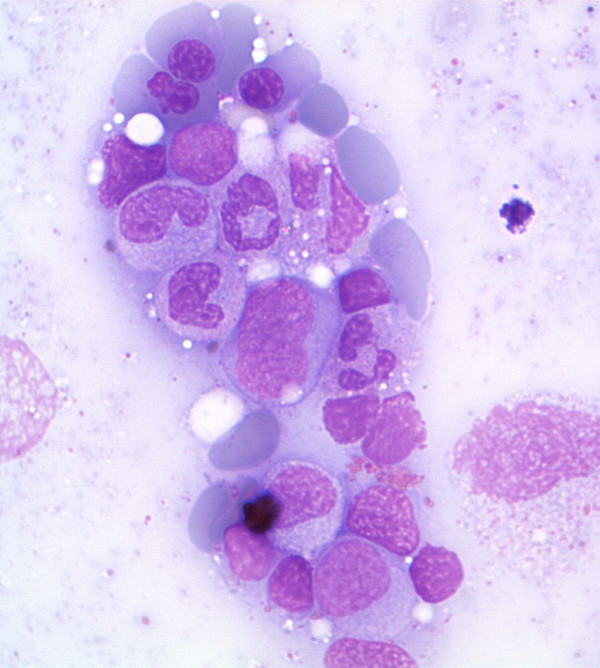
Aspirado de medula óssa na SMD a demostrar células eritroides displásicas e precursores mieloides
Imagem: “Antiretroviral activity of 5-azacytidine during treatment of a HTLV-1 positive myelodysplastic syndrome with autoimmune manifestations” por Diamantopoulos, P.T. et al. Licença: CC BY 2.0Após a confirmação da SMD, os doentes são categorizados com base na 5.ª edição da Classificação de Tumores Hematolinfóides da OMS, publicada em 2022.
A classificação é baseada em:
Tipos: