A síndrome de dificuldade respiratória aguda (ARDS, pela sigla em inglês) é caracterizada pelo início súbito de hipoxemia e edema Edema Edema is a condition in which excess serous fluid accumulates in the body cavity or interstitial space of connective tissues. Edema is a symptom observed in several medical conditions. It can be categorized into 2 types, namely, peripheral (in the extremities) and internal (in an organ or body cavity). Edema pulmonar bilateral sem insuficiência cardíaca. A sépsis é a causa mais MAIS Androgen Insensitivity Syndrome comum de ARDS. O mecanismo subjacente e a correlação histológica é o dano alveolar difuso (DAD), que consiste na lesão das células endoteliais e epiteliais do alvéolo, com consequente inflamação e desenvolvimento de membranas hialinas a revestir as paredes alveolares internas. Após algumas semanas, segue-se a fase de reparação, com a possibilidade de desenvolvimento de fibrose mais MAIS Androgen Insensitivity Syndrome tarde. Clinicamente, a seguinte tríade de achados favorece o diagnóstico de ARDS: dispneia aguda ou rapidamente progressiva, insuficiência respiratória hipóxica (razão pressão parcial de O2 /fração de O2 inspirado < 300 mmHg) e opacidades alveolares bilaterais na imagem do tórax. O tratamento envolve a identificação e o tratamento da etiologia subjacente, com oxigenoterapia adequada, minimizando a lesão pulmonar adicional e evitando a sobrecarga volémica. A maioria dos doentes necessita de ventilação mecânica invasiva (VMI). A síndrome de dificuldade respiratória aguda está associada a elevada mortalidade ou a complicações a longo prazo que se podem desenvolver mesmo após o tratamento.
Last updated: Dec 15, 2025
A síndrome da dificuldade respiratória aguda é uma síndrome clínica (não um diagnóstico patológico) caracterizada por um início súbito de hipoxemia e edema Edema Edema is a condition in which excess serous fluid accumulates in the body cavity or interstitial space of connective tissues. Edema is a symptom observed in several medical conditions. It can be categorized into 2 types, namely, peripheral (in the extremities) and internal (in an organ or body cavity). Edema pulmonar bilateral sem insuficiência cardíaca.
O mecanismo subjacente da ARDS é o dano alveolar difuso (DAD):
A síndrome de dificuldade respiratória aguda é diagnosticada clinicamente através dos critérios de diagnóstico de Berlim.
A síndrome de dificuldade respiratória aguda resulta de doenças que afetam os pulmões direta ou indiretamente.
Lesão pulmonar direta:
Lesão pulmonar indireta:
Risco de ARDS:
A síndrome da dificuldade respiratória aguda começa com uma lesão inicial dos pneumócitos e do endotélio pulmonar, que despoleta uma reação em cadeia de aumento da inflamação e da lesão pulmonar, que pode ter uma distribuição irregular/desigual.
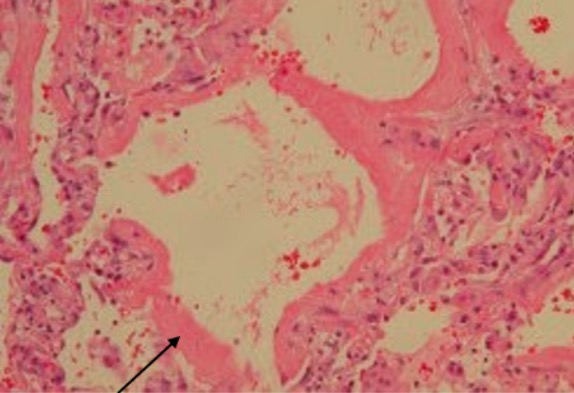
Síndrome de dificuldade respiratória aguda:
Um homem de 68 anos teve linfoma de células do manto e foi submetido a quimioterapia. Foi internado por febre e insuficiência respiratória. O envolvimento pulmonar por linfoma de células do manto foi excluído. A biópsia pulmonar toracoscópica videoassistida revelou dano alveolar difuso com membranas hialinas que revestem as superfícies alveolares (seta), o que é consistente com ARDS.
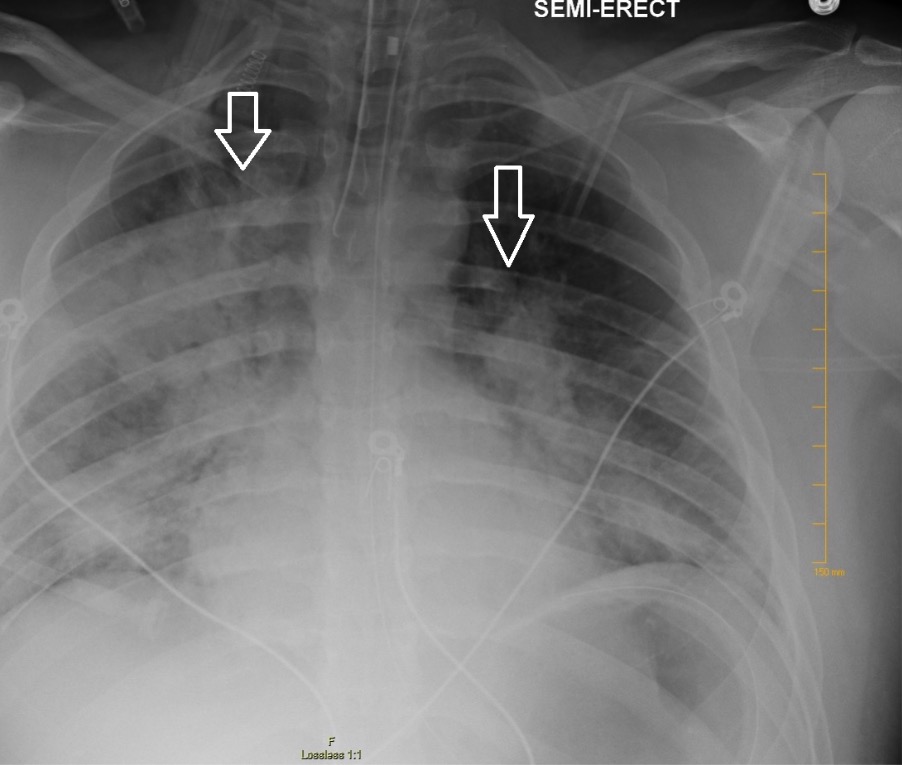
Radiografia de tórax que mostra infiltrados irregulares bilaterais sugestivos de ARDS
Imagem: “Chest radiography demonstrating bilateral hilar opacities” de Ologun G O, Ridley D, Chea N D, et al. (September 08, 2017). Severe ARDS after laparoscopic appendectomy in a young adult. Cureus 9(9): e1664. doi:10.7759/cureus.1664. Licença: CC BY 4.0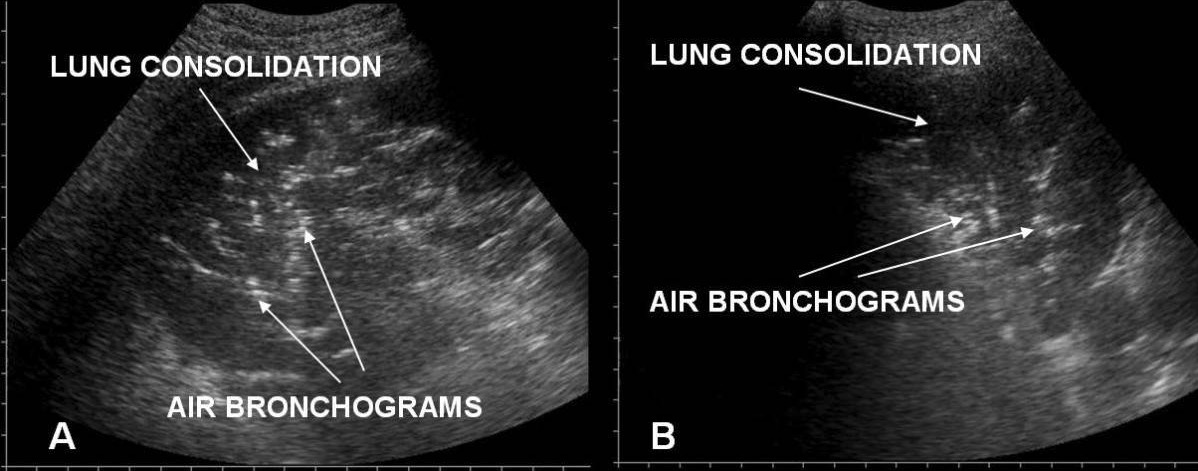
Síndrome de dificuldade respiratória aguda versus edema pulmonar cardiogénico agudo na ecografia de tórax/pulmão:
A: linha pleural irregular na ARDS
B: linha pleural uniforme no edema agudo de pulmão cardiogénico
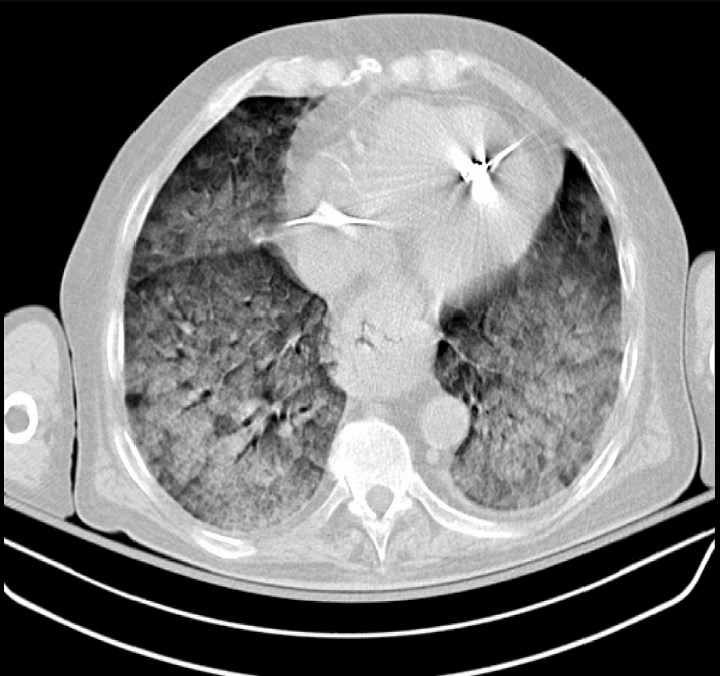
Tomografia computadorizada que mostra uma ARDS grave: opacificações pulmonares difusas bilaterais
Imagem: “Chest CT scan indicative of severe ARDS” de Zagkotsis G, Markou M, Papanikolaou P, et al. (January 24, 2021). Acute Respiratory Distress Syndrome Induced by Parathyroid Storm. Cureus 13(1): e12881. doi:10.7759/cureus.12881. Licença: CC BY 4.0Quase todos os doentes são tratados na UCI
A síndrome de dificuldade respiratória aguda é uma condição grave que está geralmente associada a elevada mortalidade e morbilidade.
Foram identificados vários fatores de risco que podem estimar o prognóstico de um doente com ARDS:
A maioria dos doentes recupera a sua função pulmonar quase na totalidade, mas é um processo que levará meses.
Complicações a longo prazo: