A síndrome de Cowden, também conhecida como síndrome do hamartoma múltiplo, é uma doença hereditária autossómica dominante que se apresenta com crescimentos múltiplos e não cancerígenos em várias partes do corpo. A síndrome é classificada como uma síndrome de tumor hamartoma homólogo de fosfatase e tensina (PTEN, pela sigla em inglês) causado por mutações no gene PTEN. Os doentes geralmente apresentam macrocefalia, triquilemomas (tumores do folículo piloso) e pápulas papilomatosas na boca. A síndrome de Cowden está associada a um aumento do risco de desenvolver cancro da mama, tiroide, cólon e do endométrio. O tratamento inclui vigilância de tumores associados e cirurgias profiláticas.
Última atualização: Apr 15, 2025
A síndrome de Cowden é uma genodermatose autossómica dominante causada por uma mutação no gene PTEN e caracterizada por múltiplos hamartomas benignos em qualquer local do corpo, lesões mucocutâneas e macrocefalia.
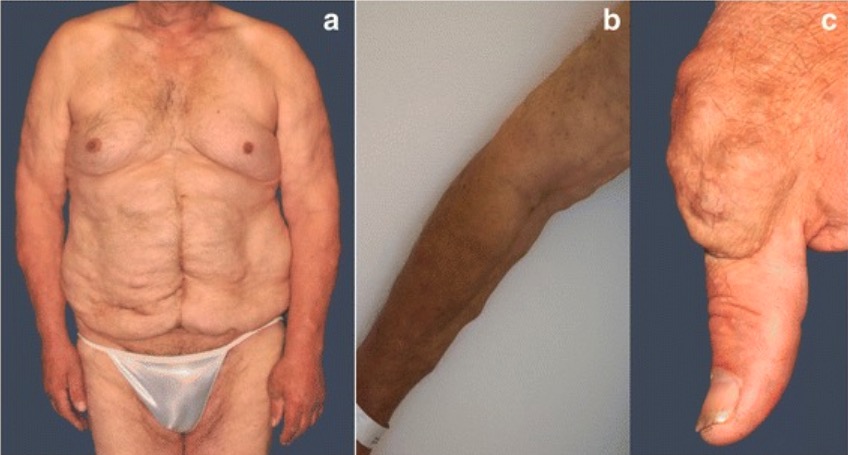
Vários tumores de tecidos moles no tronco (a), membros (b), e articulação basal do polegar esquerdo (c)
Imagem : “Fig. 2” por Steffen Pistorius et al. Licença: CC BY 4.0
Macrocefalia e glândula tiroideia difusamente aumentada em doente pediátrico com síndrome de Cowden
Imagem : “Diffusely enlarged thyroid gland” por Cláudia Patraquim et al. Licença: CC BY 2.0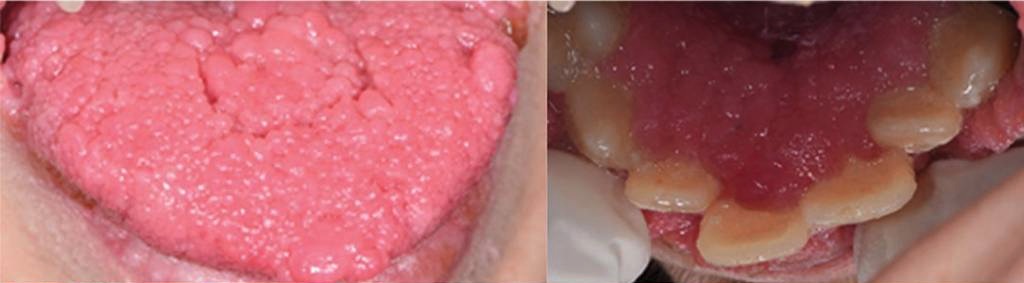
Esquerda: múltiplas lesões papilomatosas na língua
Direita: múltiplas lesões papilomatosas coalescentes cobrindo a região cervical dos dentes
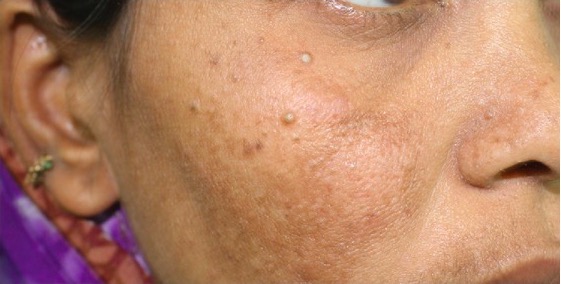
Triquilemomas no osso malar direito de um doente com doença de hamartoma múltiplo
Imagem : “Trichilemmomas on the right malar bone” por Prashanthi Chippagiri et al. Licença: CC BY 3.0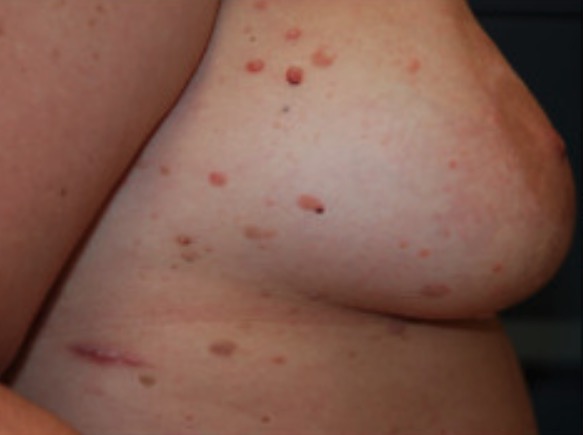
Queratoses seborreicas múltiplas num doente com carcinoma da mama bilateral de início precoce
Imagem: “Cutaneous findings of our case” por Laura Maria Pradella et al. Licença: CC BY 2.0, editado por Lecturio.Os exames laboratoriais são dirigidos pela apresentação clínica. A síndrome de Cowden pode apresentar-se com anemia (por perdas GI), doença renal, doença da tiroide e lesões cutâneas).
Com base nas queixas à apresentação, as imagens para a síndrome de Cowden podem incluir: