A imunidade a agentes patogénicos está dividida em resposta imune inata e adaptativa. A resposta imune inata é a primeira linha de defesa contra uma variedade de bactérias, fungos, vírus e parasitas. Da mesma forma que a imunidade inata está presente em todos os microorganismos multicelulares. A resposta imune inata é ativada em minutos a horas após a exposição a uma infeção, o que reduz a invasão de microorganismos nos estadios iniciais. O patógeno possui componentes específicos reconhecidos por recetores de reconhecimento de padrões (PRRs). Após a identificação de uma invasão microbiana, os componentes não celulares (incluindo o sistema complemento e as citocinas) agem em conjunto com os elementos celulares para atingir o recrutamento celular, morte microbiana direta ou indução de fagocitose. Todas as etapas visam eliminar o agente patogénico. Os mecanismos antimicrobianos na fagocitose incluem acidificação e explosão respiratória/oxidativa. O processo termina com a eliminação da ameaça, mantendo a homeostase imunológica. A defesa também é importante na ativação do sistema imunológico adaptativo.
Última atualização: Mar 11, 2023
O sistema imunológico fornece a defesa (imunidade) contra agentes patogénicos invasores como vírus e parasitas; os seus diferentes componentes estão interligados pela circulação sanguínea e linfática.
Existem duas linhas de defesa sobrepostas:
| Imunidade inata | Imunidade adaptativa | |
|---|---|---|
| Genética | Codificada por linha germinativa | Rearranjos entre genes envolvidos no desenvolvimento de linfócitos |
| Resposta imune | Inespecífico | Altamente específica |
| Tempo de resposta | Imediato (minutos a horas) | Desenvolve-se por um longo período de tempo |
| Resposta de memória | Nenhuma | Responde rapidamente ao reconhecimento do antigénio com resposta de memória |
| Reconhecimento do agente patogénico | Os recetores de reconhecimento de padrões (PRRs, pela sigla em inglês), como recetores Toll-like (TLRs, pela sigla em inglês) reconhecem padrões moleculares associados a agentes patogénicos (PAMPs, pela sigla em inglês) |
|
| Componentes |
|
|
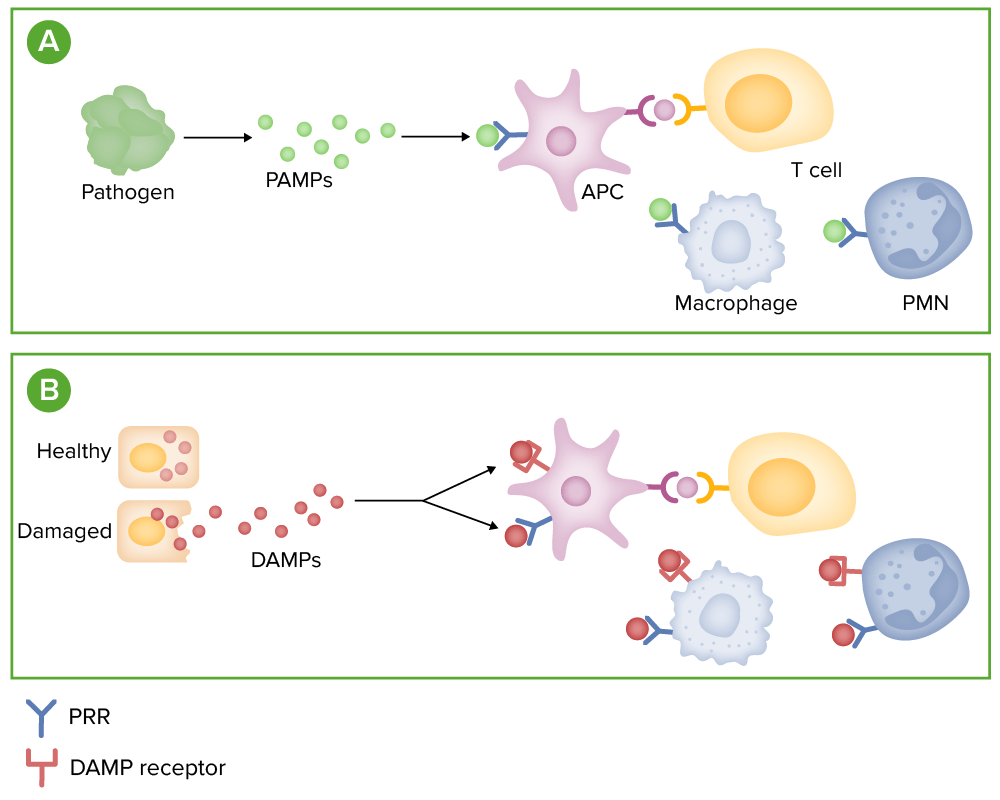
Deteção de microorganismos:
(A) Os microorganismos libertam padrões moleculares associados a agentes patogénicos (PAMPs, pela sigla em inglês), que podem ligar-se a recetores de reconhecimento de padrões (PRRs, pela sigla em inglês), tais como recetores toll-like em células imunes.
(B) As células afetadas ou danificadas libertam moléculas, denominadas padrões moleculares associados a dano (DAMPs, pela sigla em inglês). Estas moléculas ligam-se tanto a PRRs como a recetores especiais de DAMP, nas células imunes.
A ligação destes recetores promove a libertação de mediadores inflamatórios, tais como as citocinas, as quimiocinas e o complemento.
PMN, pela sigla em inglês: leucócitos polimorfonucleares
As células epiteliais revestem as superfícies do corpo e são frequentemente expostas a antigénios.
Inclui:
Os PRRs associados a células são expressos em várias células imunes e podem ser intracelulares (endolisossomal/citoplasmático) ou transmembranares.
| Recetor tipo Toll | Localização | Ligando | Origem do ligando |
|---|---|---|---|
| TLR1 | Membrana plasmática | Lipoproteína Triacil | Bactérias |
| TLR2 | Lipoproteína | Bactérias, vírus, parasitas | |
| TLR3 | Endolisossoma | dsRNA | Vírus |
| TLR4 | Membrana plasmática | LPS | Bactérias, vírus |
| TLR5 | Flagelina | Bactérias | |
| TLR6 | Diacil lipoproteína | Bactérias, vírus | |
| TLR7, TLR8 | Endolisossoma | ssRNA | Vírus, bactérias |
| TLR9 | CpG-DNA | Vírus, bactérias, protozoários | |
| TLR10 | Desconhecido | Vírus da gripe, Listeria monocytogenes |
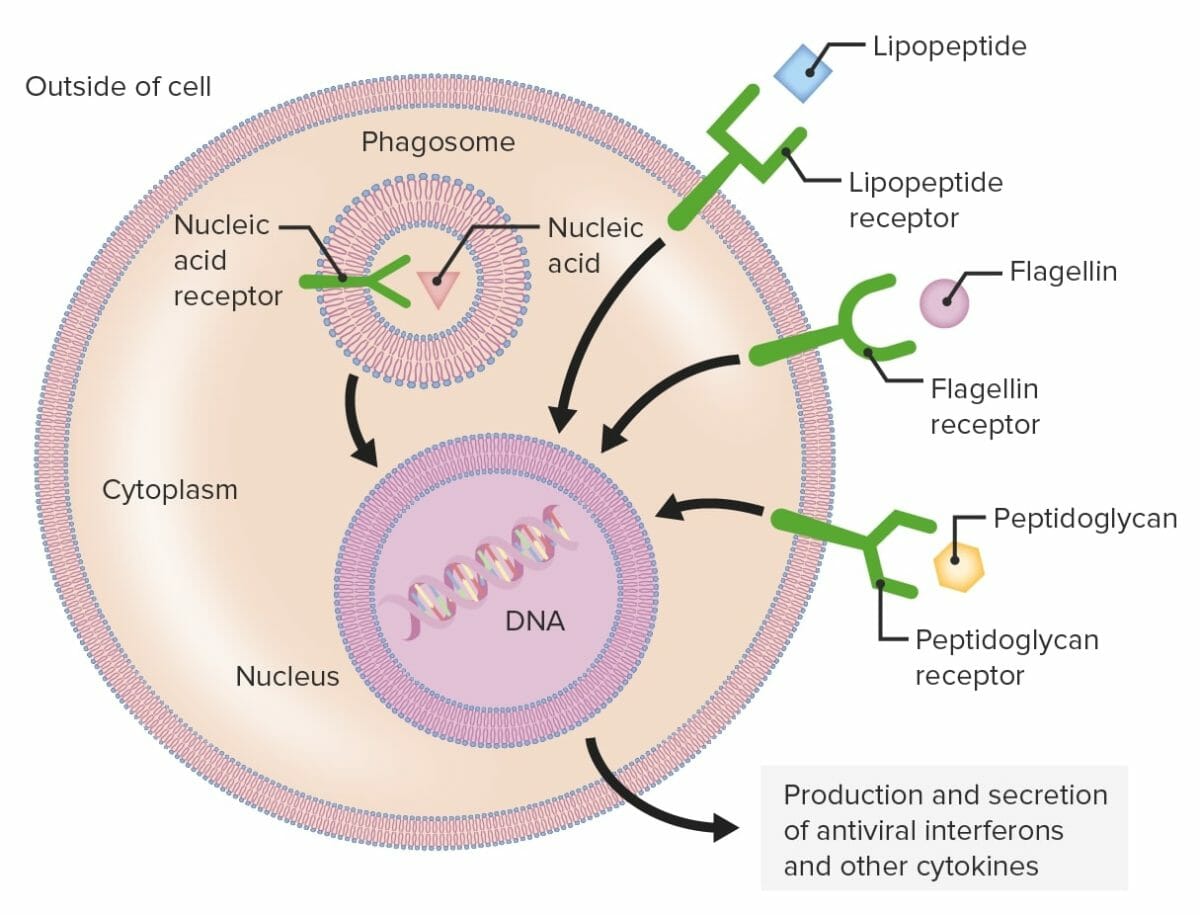
Recetores de reconhecimento de padrões (PRRs):
As células fagocíticas contêm PRRs capazes de reconhecer vários padrões moleculares associados a agentes patogénicos (PAMPs). Os recetores Toll-like (TLRs) (estruturas verdes), um grupo de PRRs, reconhecem diferentes componentes microbianos, como lipopéptidos, flagelinas ou peptidoglicanos. Os PRRs podem ser encontrados na membrana plasmática ou intracelularmente.
Quando um PRR reconhece um PAMP é enviado um sinal ao núcleo que ativa genes envolvidos na fagocitose e proliferação celular, desencadeia a morte intracelular e produção e secreção de interferões antivirais e citocinas pró-inflamatórias.
Os PRRs secretados e circulantes representam diversas proteínas (por exemplo, AMP, lectinas, coletinas).
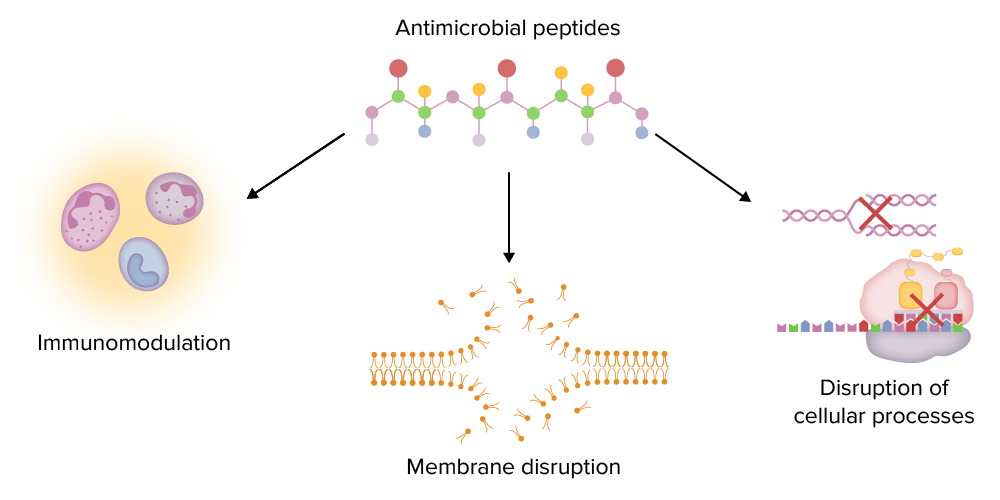
Principais funções dos péptidos antimicrobianos (AMPs, pela sigla em inglês):
Os AMPs podem modular o sistema imunitário (e.g., estimulando a quimiotaxia e regulando a produção de citocinas), perturbar as membranas dos microorganismos e perturbar processos intracelulares importantes (e.g., a síntese de ADN e proteínas).
A resposta imune segue-se ao reconhecimento de moléculas patogénicas. O sistema do complemento é uma resposta ativada em cascata para destruir os microorganismos.
A ativação do complemento ocorre por vias distintas (todas começam com uma molécula iniciadora diferente), mas todas produzem C3b (a molécula central da cascata do complemento):
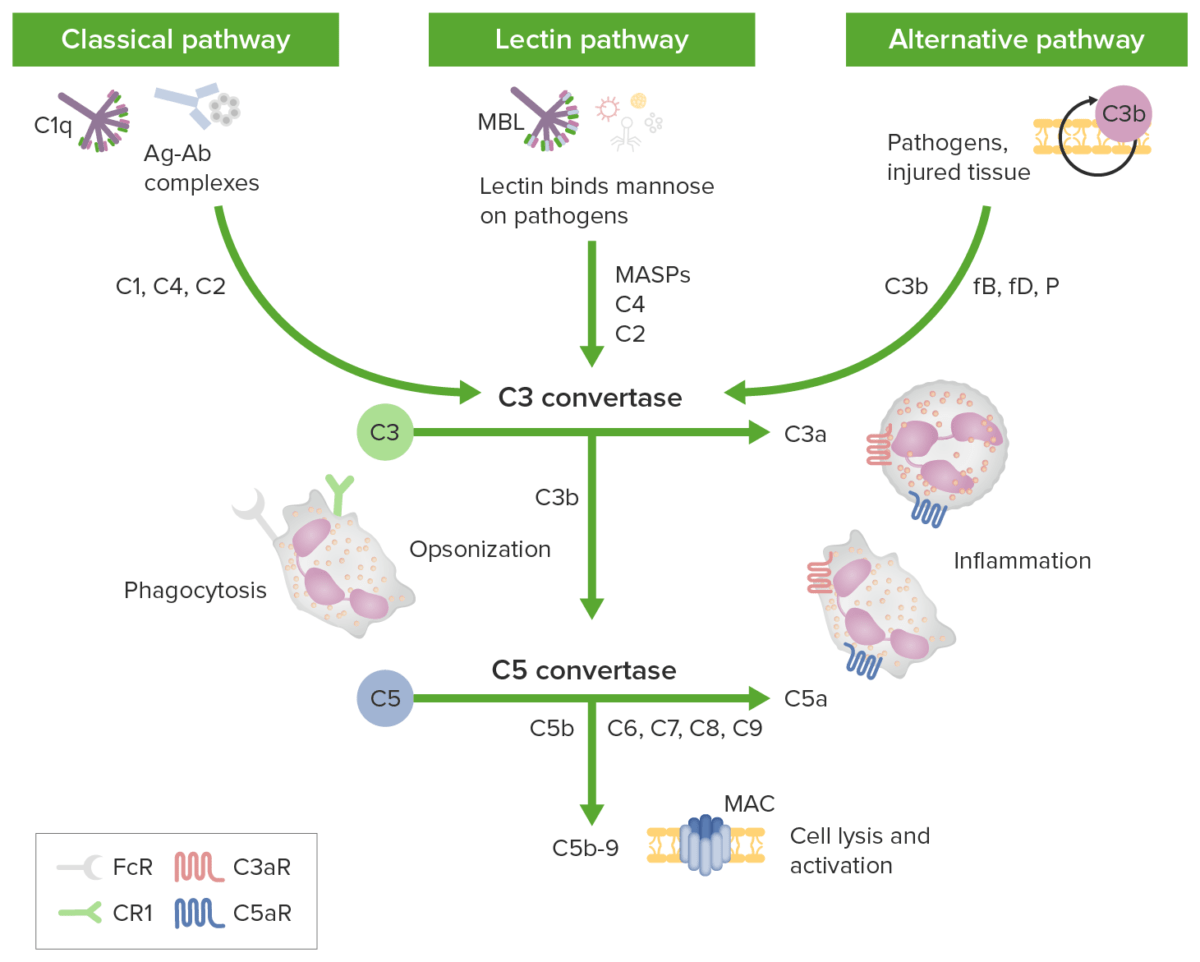
Vias de iniciação do complemento que levam a uma via terminal comum:
As caixas verdes identificam as vias de iniciação; os componentes do complemento estão identificados por setas. A via clássica é ativada por complexos antigénio-anticorpo (Complexos Ag-Ac) reconhecidos pelo complexo C1q com C1r e C1s. As proteases C1r e C1s clivam C4 e C2 para gerar a via clássica C3 convertase C4b2b. A via da lectina é desencadeada pela ligação de lectina ligante a manose (MBL, pela sigla em inglês) ou ficolinas a hidratos de carbono na membrana-alvo. As proteases de serina associadas a MBL (MASPs, pela sigla em inglês) clivam C4 e C2, gerando C3 convertase C4b2b. A via alternativa é desencadeada quando os níveis baixos de proteína C3b ligam-se diretamente a um microorganismo, material estranho ou tecido danificado. Quando a C3b se liga com o fator B, forma-se C3bB. O fator B é clivado pelo fator D para formar a via alternativa C3-convertase (C3bBb). A properdina estabiliza a convertase. A C3b opsoniza os alvos para fagocitose e ativação de células B. As 3 vias de iniciação convergem em C3 com convertases C3 distintas, clivando C3 para gerar anafilatoxina C3a e mais C3b para formar as convertases C5 (C4b2a3b e C3bBb3b). A C5 convertase cliva a C5 em C5a e C5b. As anafilatoxinas C3a, C4a e C5a podem atrair/ativar células inflamatórias e contrair o músculo liso através dos recetores C3aR e C5aR. Forma-se o complexo de ataque de membrana (MAC, pela sigla em inglês) após ligação de C5b a C6, C7, C8 e múltiplas cópias de C9. Os poros do MAC podem causar a morte celular pelo fluxo osmótico.
Em última análise, as vias do complemento visam eliminar microorganismos e detritos celulares/células apoptóticas:
As citocinas são proteínas solúveis libertadas por diferentes células, que desempenham papéis sobrepostos na imunidade inata e adaptativa, como o sistema complemento.
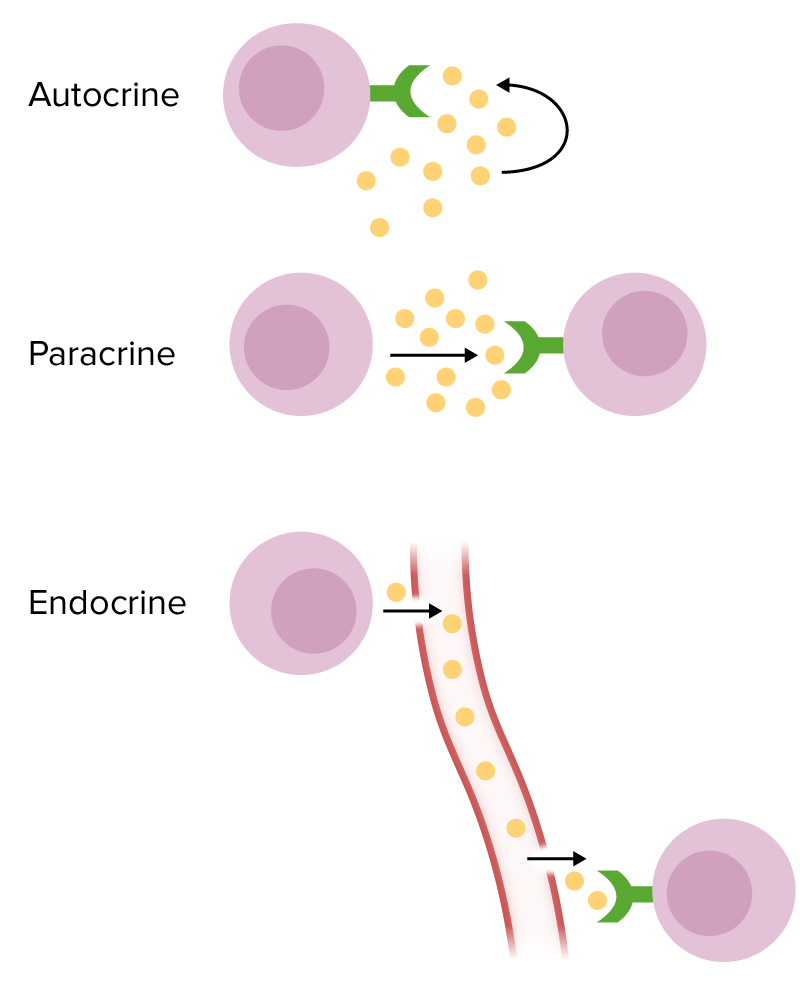
Formas de sinalização química:
Autócrina: A célula alvo é a mesma célula que segrega as citocinas.
Parácrina: A célula alvo das citocinas é uma célula próxima.
Endócrina: As citocinas são segregadas na circulação com o objetivo de alcançar uma célula-alvo distante.
| Citocinas | Origem | Função e atividade |
|---|---|---|
| IL-1 | Monócitos, macrófagos, células B, fibroblastos, maioria das células epiteliais |
|
| IL-2 | Células T |
|
| IL-3 | Células T, células NK, mastócitos | Estimulação do progenitor da hematopoiese |
| IL-4 | Células T, mastócitos, basófilos |
|
| IL-5 | Células T, mastócitos, eosinófilos |
|
| IL-6 | Monócitos, macrófagos, células B, fibroblastos, maioria das células epiteliais |
|
| IL-7 | Medula óssea, células epiteliais do timo | Diferenciação de células B, células T e células NK |
| IL-8 | Monócitos, macrófagos, células T, neutrófilos, fibroblastos, células endoteliais, células epiteliais |
|
| IL-9 | Células T |
|
| IL-10 | Monócitos, macrófagos, células T, células B, queratinócitos, mastócitos |
|
| IL-11 | Células estromais da medula óssea |
|
| IL-12 | Ativação de macrófagos, células dendríticas, neutrófilos |
|
| IFN-ɣ | Células T, células NK |
|
| TNF-ɑ | Monócitos, macrófagos, mastócitos, basófilos, eosinófilos, células NK, células B, células T, fibroblastos, células epiteliais tímicas |
|
| Fator de crescimento transformador-β | A maioria das células | Anti-inflamatório |
Após o reconhecimento do agente patogénico e o recrutamento de células imunes (com a ajuda coordenada do complemento e de citocinas), são implementadas estratégias para eliminar os microorganismos.
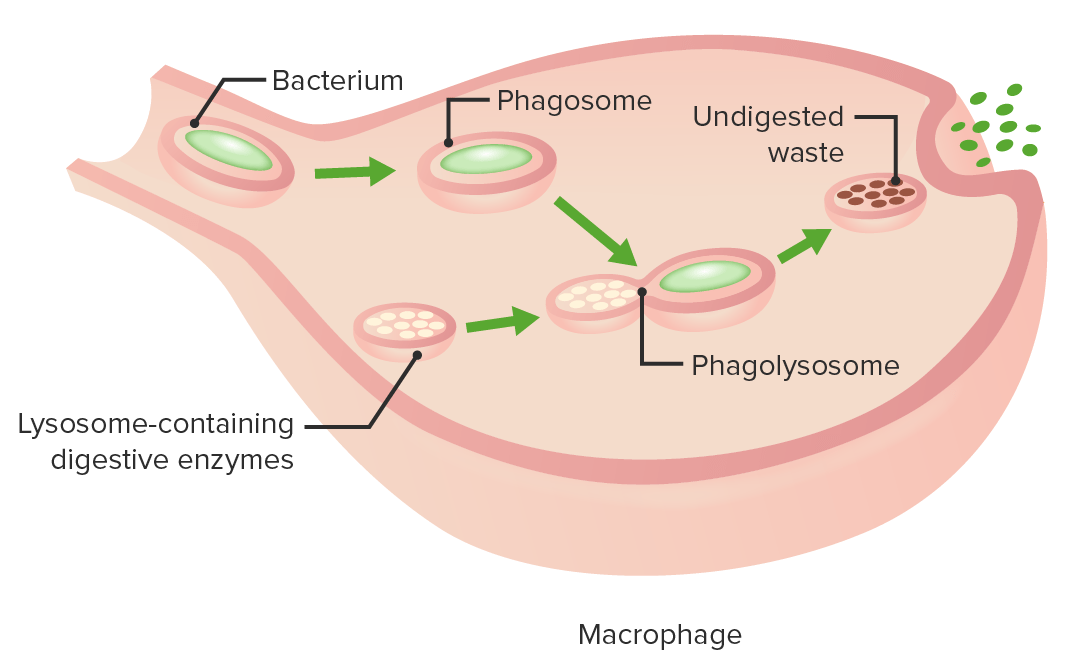
Estadios da fagocitose:
Formação de um fagossoma, digestão da partícula patogénica no fagolisossoma, expulsão de materiais não digeridos da célula
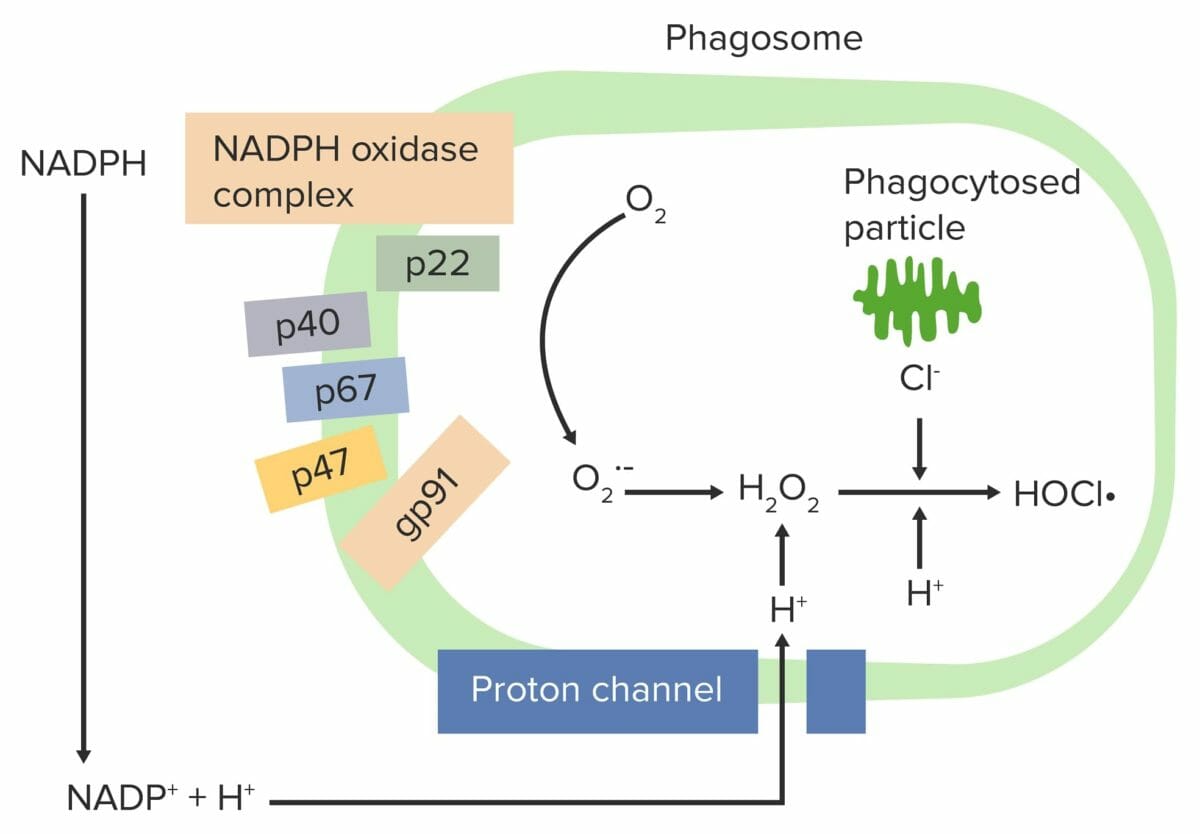
Explosão respiratória iniciada pelo complexo NADPH-oxidase:
O complexo fagócito NADPH-oxidase é ativado, reduzindo o O2 a um radical livre de oxigénio (anião superóxido (O2•–)) e depois a H2O2. Os neutrófilos e monócitos (através da mieloperoxidase) combinam H2O2 com Cl– para produzir o hipoclorito (HOCl•), que ajuda a destruir as bactérias.