O cancro do colo do útero é a terceira neoplasia ginecológica mais MAIS Androgen Insensitivity Syndrome comum. Mais MAIS Androgen Insensitivity Syndrome de 90% dos casos de cancro do colo do útero estão associados ao vírus do papiloma humano de alto risco (hrHPV, pela sigla em inglês), que é transmitido por contacto sexual. O cancro do colo do útero pode ser prevenido pela deteção precoce e pelo tratamento de lesões pré-malignas causadas pelo hrHPV. Os métodos de deteção são a citologia cervical e o teste de HPV HPV Human papillomavirus (HPV) is a nonenveloped, circular, double-stranded DNA virus belonging to the Papillomaviridae family. Humans are the only reservoir, and transmission occurs through close skin-to-skin or sexual contact. Human papillomaviruses infect basal epithelial cells and can affect cell-regulatory proteins to result in cell proliferation. Papillomavirus (HPV). As guidelines variam quanto à idade de início do rastreio, com várias sociedades dos EUA a recomendarem que o rastreio comece entre os 21 e os 25 anos, enquanto que a Organização Mundial de Saúde (OMS) sugere esperar até aos 30 anos, especialmente em contextos onde os são recursos limitados. As guidelines também variam quanto ao método de teste preferido, embora o teste HPV HPV Human papillomavirus (HPV) is a nonenveloped, circular, double-stranded DNA virus belonging to the Papillomaviridae family. Humans are the only reservoir, and transmission occurs through close skin-to-skin or sexual contact. Human papillomaviruses infect basal epithelial cells and can affect cell-regulatory proteins to result in cell proliferation. Papillomavirus (HPV) (com ou sem citologia) seja universalmente preferido a partir dos 30 anos. Desde o início do programa de rastreio que se verificou um declínio de 75% na incidência e mortalidade por cancro do colo do útero.
Last updated: Oct 7, 2023
As estratégias de rastreio podem ser realizadas de forma independente ou concomitante (co-teste).
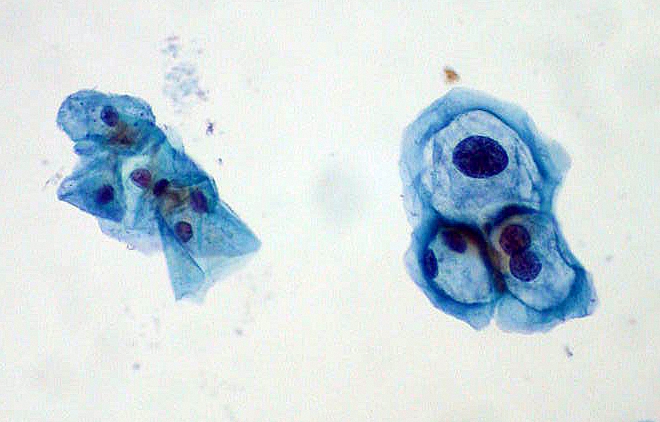
Imagem da lâmina de exame de Papanicolau para rasteio do cancro do colo do útero: à esquerda, células escamosas normais; à direita, células infetadas pelo HPV com displasia.
Imagem: “ThinPrep Papanicolau HPV” por Ed Uthman. Licença: Public Domain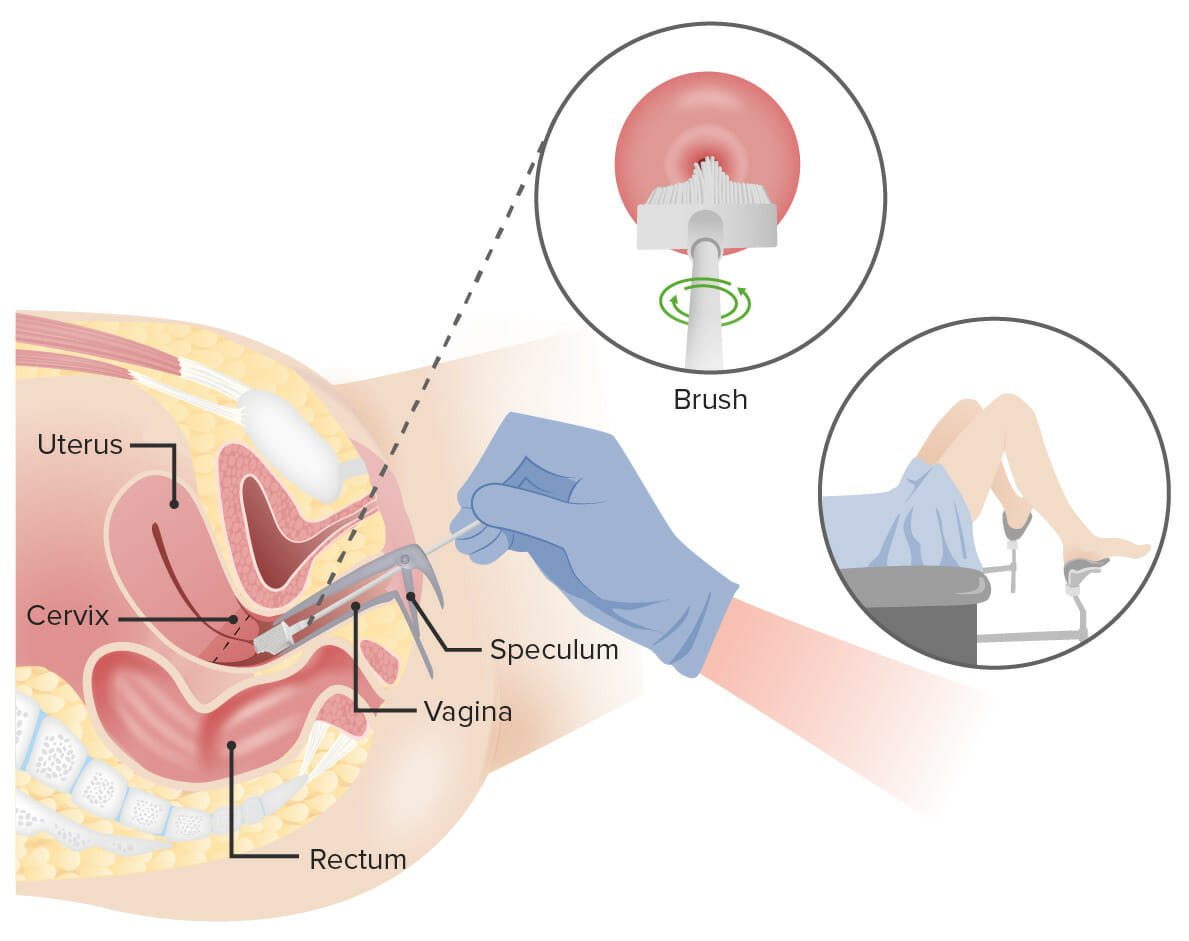
Exame de Papanicolau:
Insere-se um espéculo na vagina para a alargar. Depois, insere-se ou uma escova cervical (apresentada na imagem) ou uma escova endocervical e uma espátula na vagina para colher células do colo do útero. As células são observadas em microscopia em busca de sinais de doença.
As recomendações apresentadas são aplicáveis a indivíduos de risco médio. Este grupo inclui indivíduos que estão totalmente vacinados contra o HPV HPV Human papillomavirus (HPV) is a nonenveloped, circular, double-stranded DNA virus belonging to the Papillomaviridae family. Humans are the only reservoir, and transmission occurs through close skin-to-skin or sexual contact. Human papillomaviruses infect basal epithelial cells and can affect cell-regulatory proteins to result in cell proliferation. Papillomavirus (HPV).
Certas condições apresentam um maior risco de desenvolvimento de cancro do colo do útero, pelo que o rastreio deve ser individualizado e mais MAIS Androgen Insensitivity Syndrome frequente:
O sistema de Bethesda é uma comunicação padronizada dos resultados, que inclui a adequação da amostra, a categorização geral dos achados e os resultados.
Tipos de anomalias epiteliais de células escamosas:
Anomalias das células glandulares (categorizadas como endocervicais, endometriais, ou não especificadas):
Outros achados possíveis em relatórios de citologia cervical:
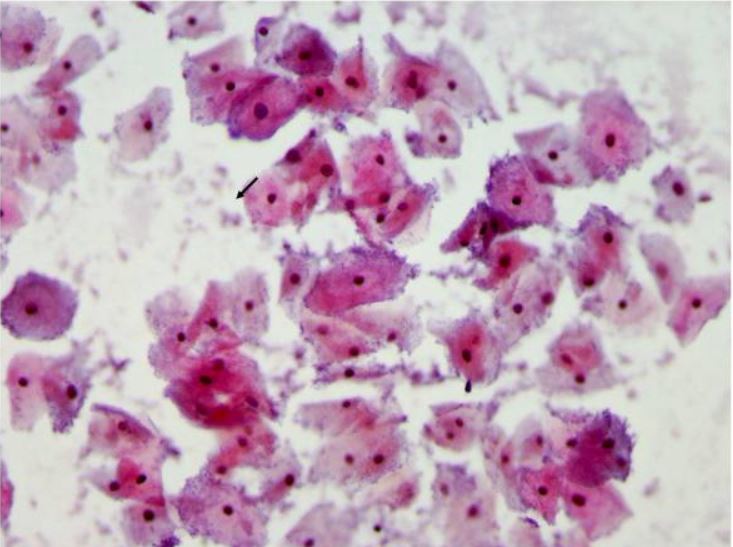
Teste de Papanicolau a demonstrar vaginose bacteriana com muitas clue cells:
As clue cells são células vaginais epiteliais cravejadas com cocobacilos aderentes, melhor visualizados na margem das células. As bactérias estão coradas azul-púrpura pela coloração de Papanicolau (setas).
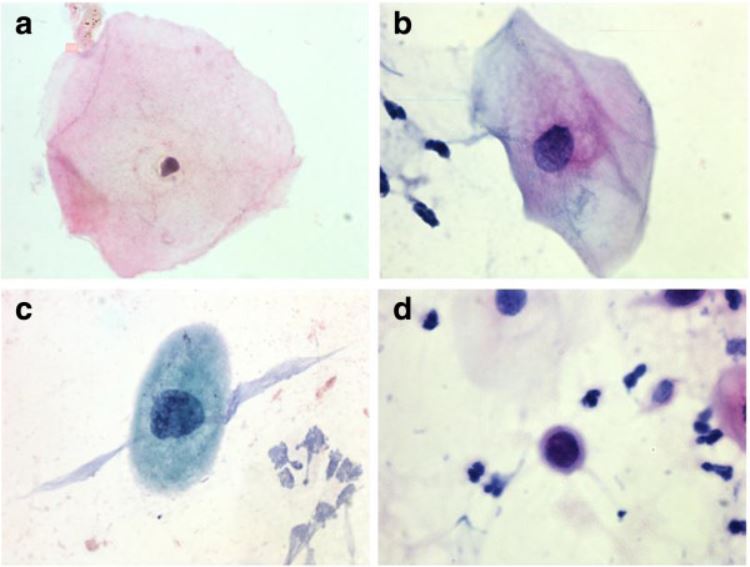
Exemplos de achados nas células escamosas durante o rastreio do cancro do colo do útero:
a. célula normal
b. ASC-US
c. LSIL
d. HSIL
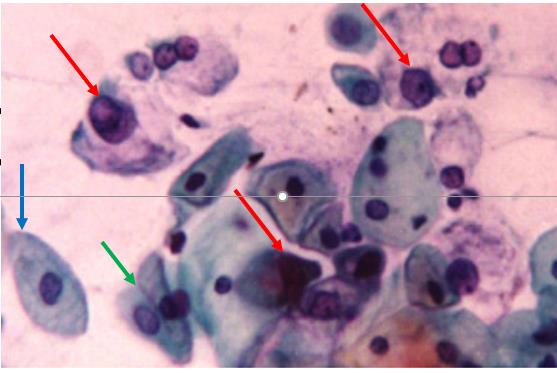
AGCUS a favorecer um processo neoplásico, em coloração de Papanicolau
Citologia cervical com células glandulares atípicas (setas vermelhas), a favorecer um processo neoplásico. A seta azul aponta para uma célula epitelial escamosa benigna e a seta verde aponta para 2 células endocervicais benignas.
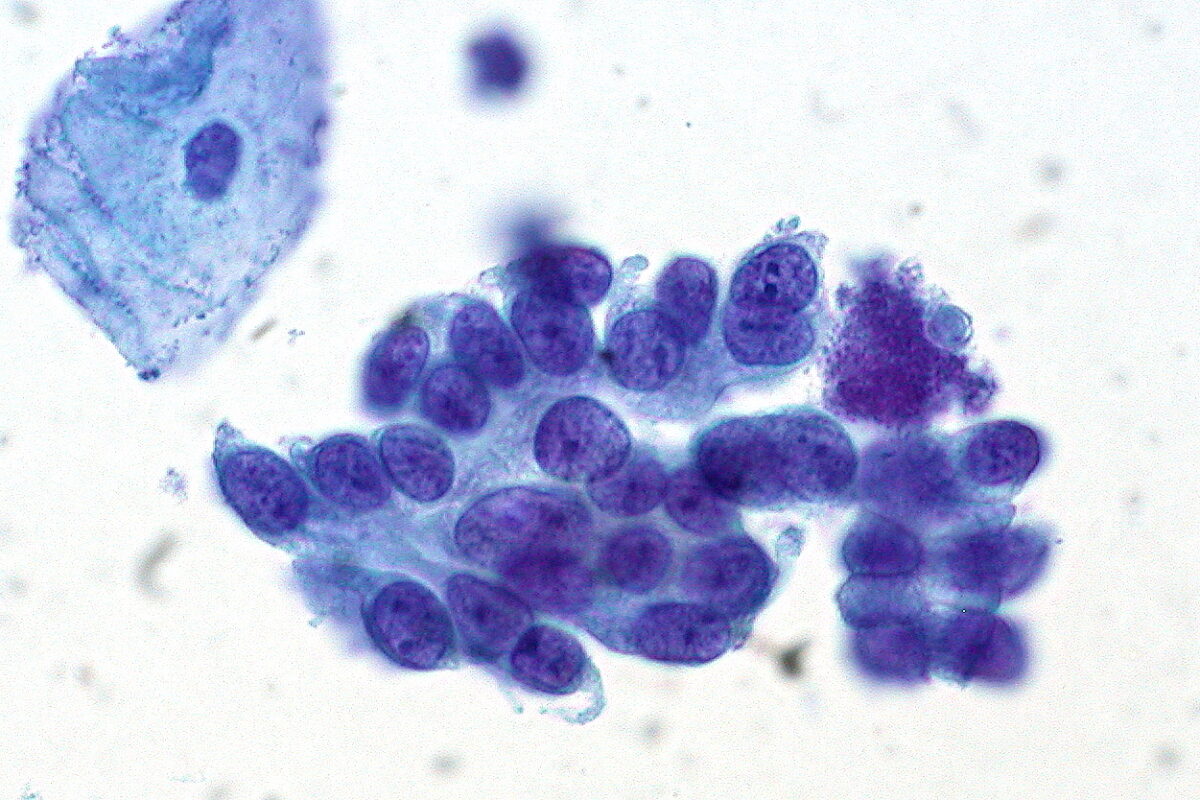
Citologia cervical com adenocarcinoma in situ do colo do útero. Note a célula epitelial escamosa benigna no canto superior esquerdo.
Imagem : “Adenocarcinoma in Situ of the Cervix” por Ed Uthman. Licença: CC BY 2.0O tratamento dos resultados anómalos do rastreio baseia-se no risco de CIN CIN An increased tendency to acquire chromosome aberrations when various processes involved in chromosome replication, repair, or segregation are dysfunctional. Colorectal Cancer 3+ (dado como percentagem) de um doente, tanto agora como daqui a 5 anos.
| Risco | Tratamento recomendado |
|---|---|
| Risco de desenvolvimento de NIC 3+ nos próximos 5 anos (limiares de ação clínica) | |
| < 0.15 % | Rastreio a cada 5 anos. |
| 0.15 % a < 0.55 % | Repetir o teste (teste primário do HPV HPV Human papillomavirus (HPV) is a nonenveloped, circular, double-stranded DNA virus belonging to the Papillomaviridae family. Humans are the only reservoir, and transmission occurs through close skin-to-skin or sexual contact. Human papillomaviruses infect basal epithelial cells and can affect cell-regulatory proteins to result in cell proliferation. Papillomavirus (HPV), co-teste) em 3 anos. |
| 0.55 % a < 4 % | Repetir o teste dentro de 1 ano. |
| Risco imediato de NIC 3+ (limiares de ação clínica) | |
| 4 % a < 25 % | Colposcopia recomendada |
| 25 % a < 60 % | É aceitável tratamento acelerado ou colposcopia (para doentes não grávidas com ≥ 25 anos) |
| ≥ 60 % | Recomendado tratamento acelerado (para doentes não grávidas ≥ 25 anos) |
| História | Resultado atual do HPV HPV Human papillomavirus (HPV) is a nonenveloped, circular, double-stranded DNA virus belonging to the Papillomaviridae family. Humans are the only reservoir, and transmission occurs through close skin-to-skin or sexual contact. Human papillomaviruses infect basal epithelial cells and can affect cell-regulatory proteins to result in cell proliferation. Papillomavirus (HPV) | Resultado citológico atual | Risco NIC 3+ imediato (%) | Risco NIC 3+ a 5 anos (%) | Tratamento recomendado |
|---|---|---|---|---|---|
| Desconhecido | HPV HPV Human papillomavirus (HPV) is a nonenveloped, circular, double-stranded DNA virus belonging to the Papillomaviridae family. Humans are the only reservoir, and transmission occurs through close skin-to-skin or sexual contact. Human papillomaviruses infect basal epithelial cells and can affect cell-regulatory proteins to result in cell proliferation. Papillomavirus (HPV) negativo | NILM | 0.00 | 0.12 | 5 anos de seguimento |
| ASC-US | 0.04 | 0.40 | 5 anos de seguimento | ||
| LSIL | 1.1 | 2.0 | 1 ano de seguimento | ||
| ASC-H | 3.4 | 3.8 | Colposcopia | ||
| HSIL+ | 25 | 27 | Colposcopia ou tratamento acelerado | ||
| HPV HPV Human papillomavirus (HPV) is a nonenveloped, circular, double-stranded DNA virus belonging to the Papillomaviridae family. Humans are the only reservoir, and transmission occurs through close skin-to-skin or sexual contact. Human papillomaviruses infect basal epithelial cells and can affect cell-regulatory proteins to result in cell proliferation. Papillomavirus (HPV) positivo | NILM | 2.1 | 4.8 | 1 ano de seguimento | |
| ASC-US | 4.4 | 7.3 | Colposcopia | ||
| LSIL | 4.3 | 6.9 | Colposcopia | ||
| ASC-H | 26 | 33 | Colposcopia ou tratamento acelerado | ||
| HSIL+ | 49 | 53 | Colposcopia ou tratamento acelerado | ||
| HPV HPV Human papillomavirus (HPV) is a nonenveloped, circular, double-stranded DNA virus belonging to the Papillomaviridae family. Humans are the only reservoir, and transmission occurs through close skin-to-skin or sexual contact. Human papillomaviruses infect basal epithelial cells and can affect cell-regulatory proteins to result in cell proliferation. Papillomavirus (HPV) negativo | HPV HPV Human papillomavirus (HPV) is a nonenveloped, circular, double-stranded DNA virus belonging to the Papillomaviridae family. Humans are the only reservoir, and transmission occurs through close skin-to-skin or sexual contact. Human papillomaviruses infect basal epithelial cells and can affect cell-regulatory proteins to result in cell proliferation. Papillomavirus (HPV) negativo | NILM | 0.00 | 0.09 | 5 anos de seguimento |
| ASC-US | 0.01 | 0.36 | 3 anos de seguimento | ||
| LSIL | 0.44 | 0.79 | 1 ano de seguimento | ||
| ASC-H | 2.8 | 3.3 | Colposcopia | ||
| HSIL+ | 14 | 14 | Colposcopia | ||
| HPV HPV Human papillomavirus (HPV) is a nonenveloped, circular, double-stranded DNA virus belonging to the Papillomaviridae family. Humans are the only reservoir, and transmission occurs through close skin-to-skin or sexual contact. Human papillomaviruses infect basal epithelial cells and can affect cell-regulatory proteins to result in cell proliferation. Papillomavirus (HPV) positivo | NILM | 0.74 | 2.3 | 1 ano de seguimento | |
| ASC-US | 2.0 | 3.8 | 1 ano de seguimento | ||
| LSIL | 2.1 | 3.8 | 1 ano de seguimento | ||
| ASC-H | 14 | 18 | Colposcopia | ||
| HSIL+ | 32 | 34 | Colposcopia ou tratamento acelerado |