Os aminoácidos (AA) são compostos por um átomo central de carbono ligado a um grupo carboxilo, um grupo amina, um átomo de hidrogénio e uma cadeia lateral (grupo R). Existem centenas de AA encontrados na natureza, mas apenas 20 são os blocos de construção de proteínas em humanos (proteogénicos). Nove destes 20 são "essenciais", pois não podem ser sintetizados. Os aminoácidos diferem uns dos outros apenas na natureza química do grupo R. Eles são mais frequentemente classificados de acordo com a sua interação com a água, como hidrofóbicos, hidrofílicos, ou iónicos.
Última atualização: Jan 6, 2023
Cada aminoácido (AA) é composto por um carbono alfa, ou central, ligado a:
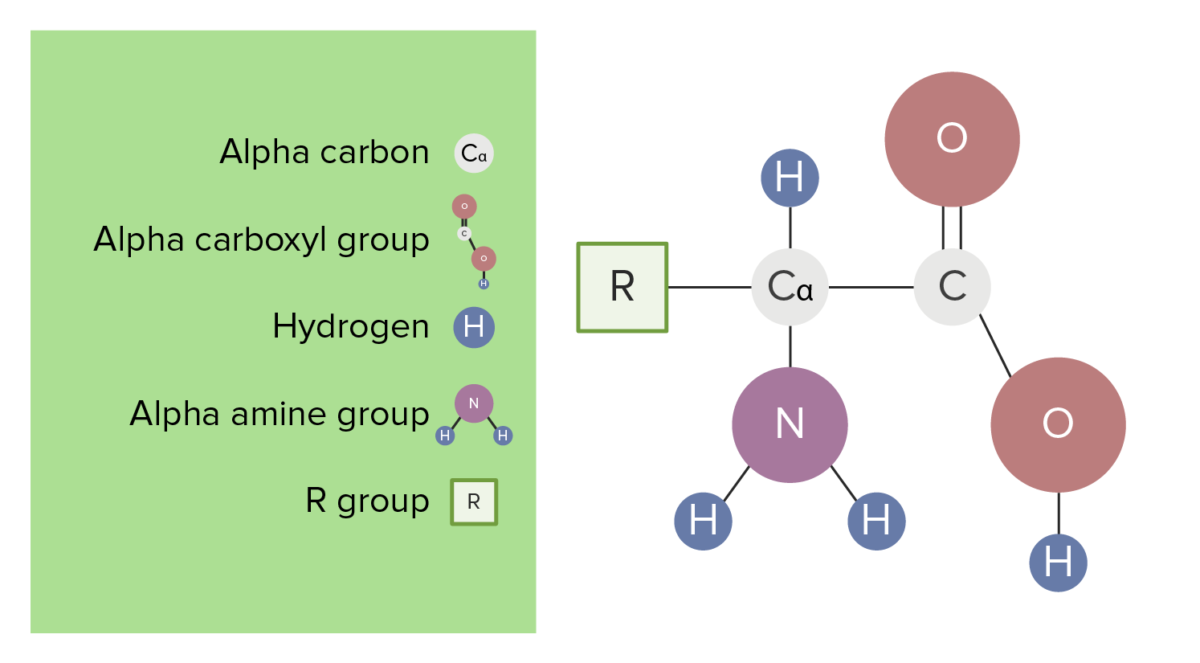
A estrutura básica dos aminoácidos
Image by Lecturio.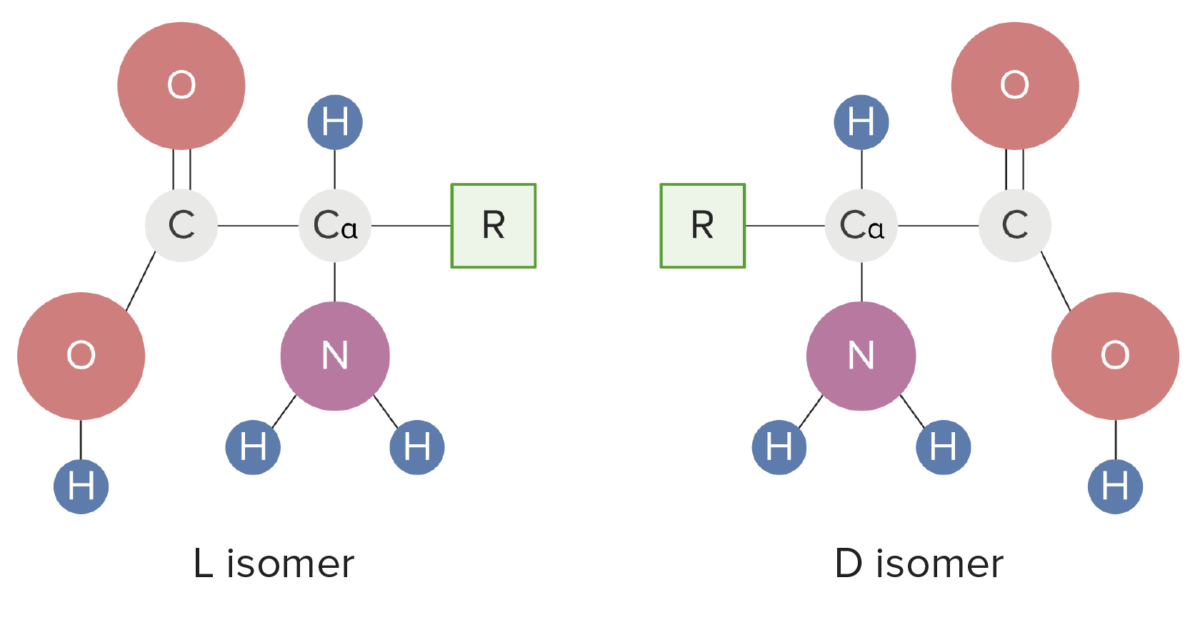
Formas isoméricas de aminoácidos
Image by Lecturio.Os grupos R determinam as diferenças na estrutura, função e interações biológicas dos AA.
Os grupos R podem ser classificados de duas formas:
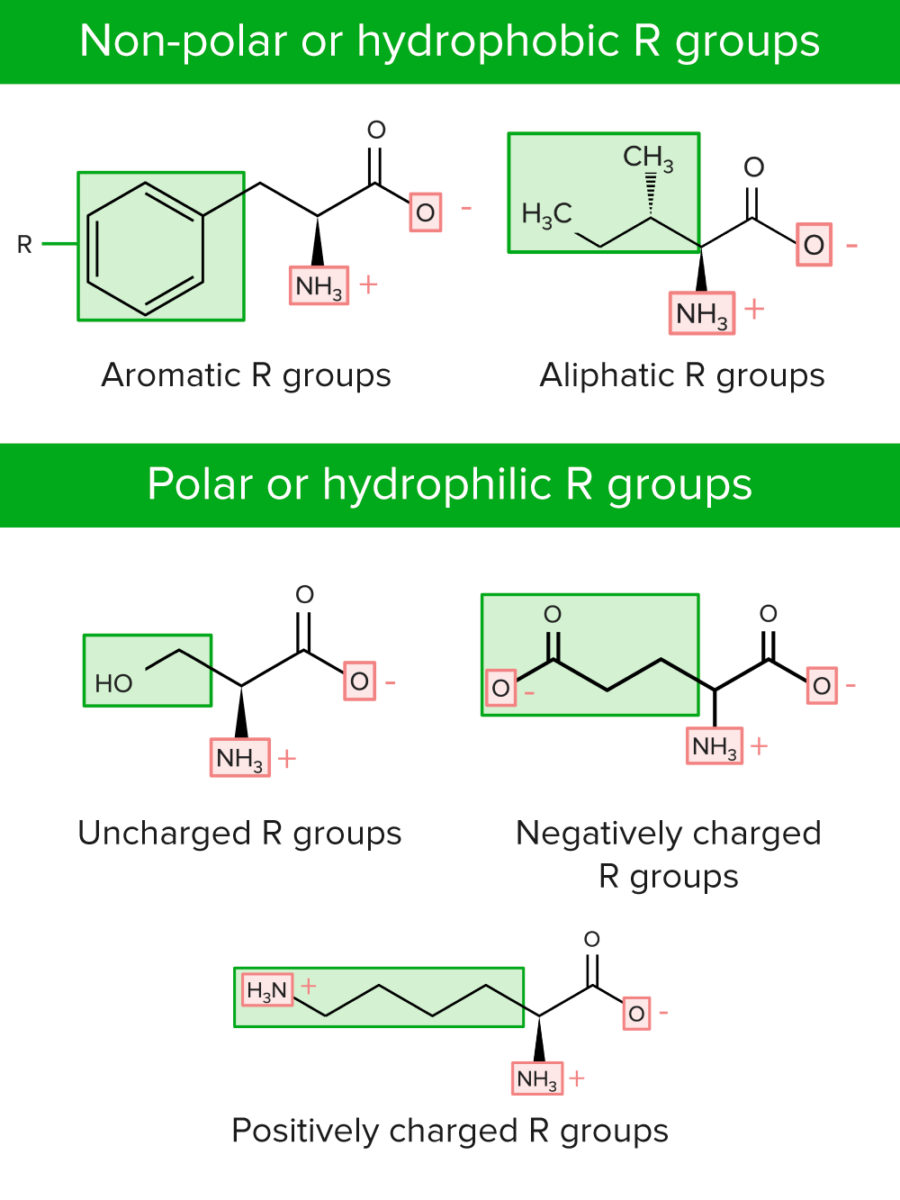
Categorias de grupos R ou cadeias laterais de aminoácidos
Image by Lecturio.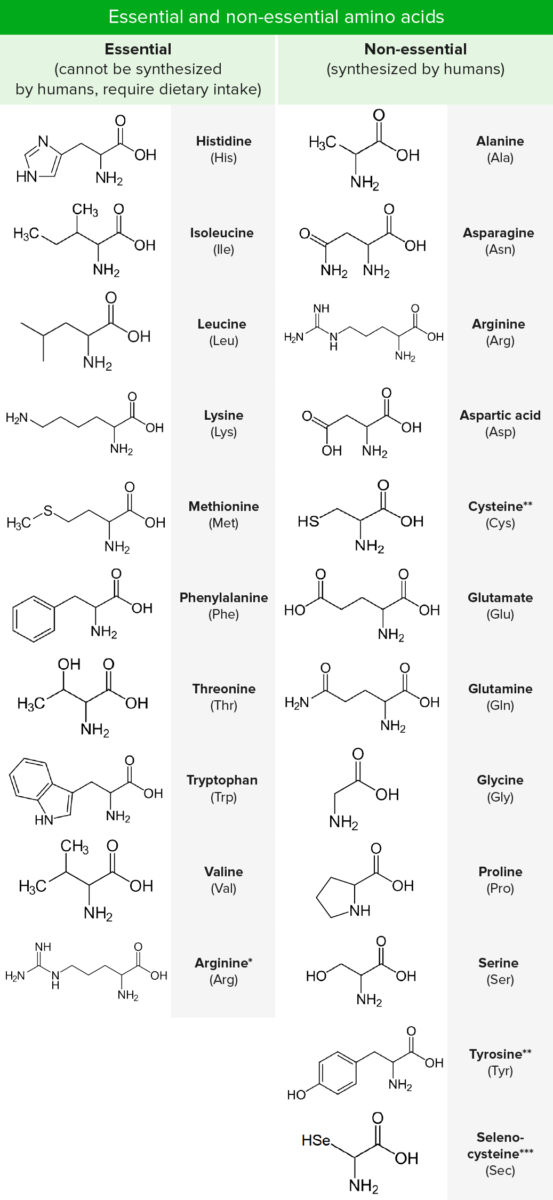
*Necessário apenas durante períodos de crescimento ou saldo positivo de azoto.
**Sintetizado a partir de AA essenciais.
***Análogo de cisteína com selénio em vez do habitual enxofre. Não diretamente codificado no código genético
| Não polar ou hidrofóbico | Polares ou hidrofílicos | ||
|---|---|---|---|
| Aromático |
|
Carregado positivamente ou básico |
|
| Alifático |
|
Não carregado |
|
| Carregado negativamente ou ácido |
|
||

Forma Zwitterião
Image by Lecturio.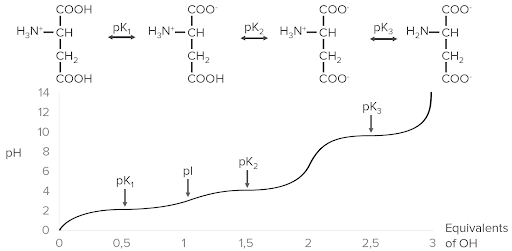
Exemplo de ionização com ácido aspártico. Em cima estão as 4 diferentes formas que podem existir com a ionização. Observe como, à medida que equivalentes de hidroxilo (OH), traçados no eixo x, são adicionados, o pH (eixo y) aumenta. À medida que o pH aumenta, os valores de pK são alcançados e progressivamente mais iões de hidrogénio (protões) são libertados do ácido aspártico, diminuindo a sua carga.
Image by Lecturio.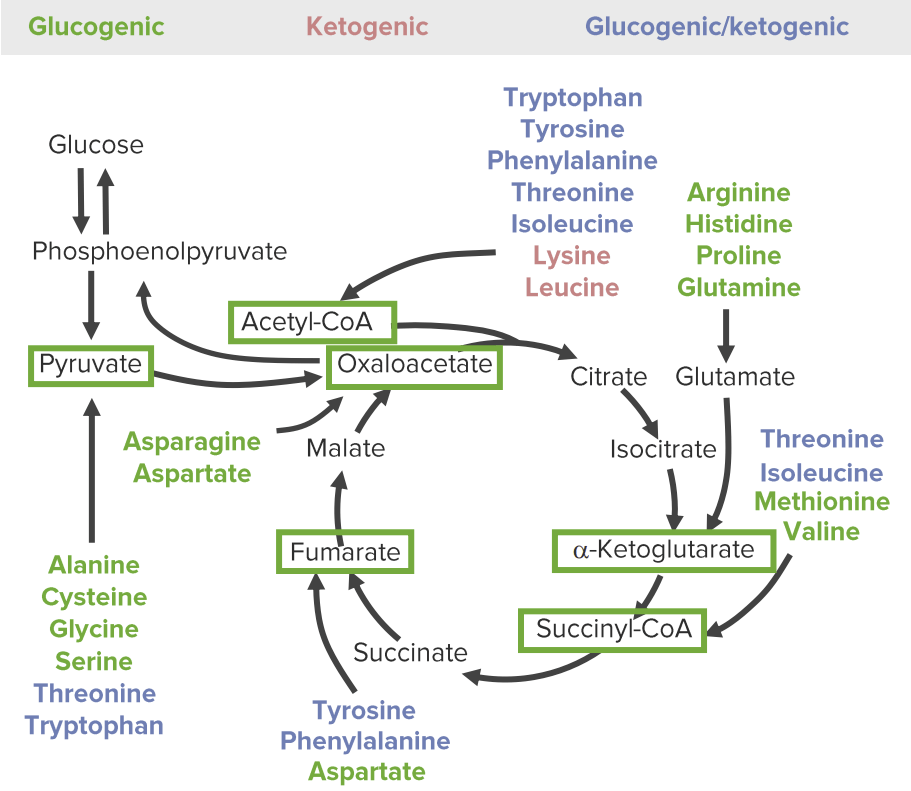
As 3 categorias de produtos catabólicos de aminoácidos: glucogénicos (verde), cetogénicos (vermelho), e ambos glucogénicos e cetogénicos (azul). A via glucose-piruvato à esquerda representa a glicólise e a gluconeogénese. A via cíclica à direita representa o ciclo do ácido cítrico. Todos os aminoácidos são degradados em 1 de 6 intermediários (caixas verdes): piruvato, acetil-CoA, oxaloacetato, alfa-cetoglutarato, succinil-CoA, e fumarato.
Image by Lecturio.O catabolismo dos AA envolve reações anapleróticas (reações químicas que formam intermediários de vias metabólicas).
Os aminoácidos podem ser classificados pelos produtos catabólicos e em quais vias metabólicas eles servirão como intermediários: