O glicogénio é um polímero ramificado e a forma de armazenamento de hidratos de carbono no corpo humano. Os principais locais de armazenamento são o fígado e o músculo esquelético. O glicogénio é a principal fonte de energia durante o jejum ou entre as refeições. O glicogénio fornece energia por até 18 horas, após as quais as necessidades de energia são cumpridas pela oxidação dos ácidos gordos. As 2 vias metabólicas do glicogénio são a glicogénese (síntese de glicogénio) e a glicogenólise (quebra de glicogénio). As principais enzimas regulatórias nesses processos são a glicogénio sintase (na glicogénese) e a glicogénio fosforilase (na glicogenólise). Estas vias ocorrem em função das necessidades energéticas das células, geralmente moduladas por reguladores hormonais e alostéricos. A acumulação anormal de glicogénio ocorre com deficiências enzimáticas, o que causa diferentes tipos de perturbações de armazenamento de glicogénio.
Last updated: Apr 25, 2025
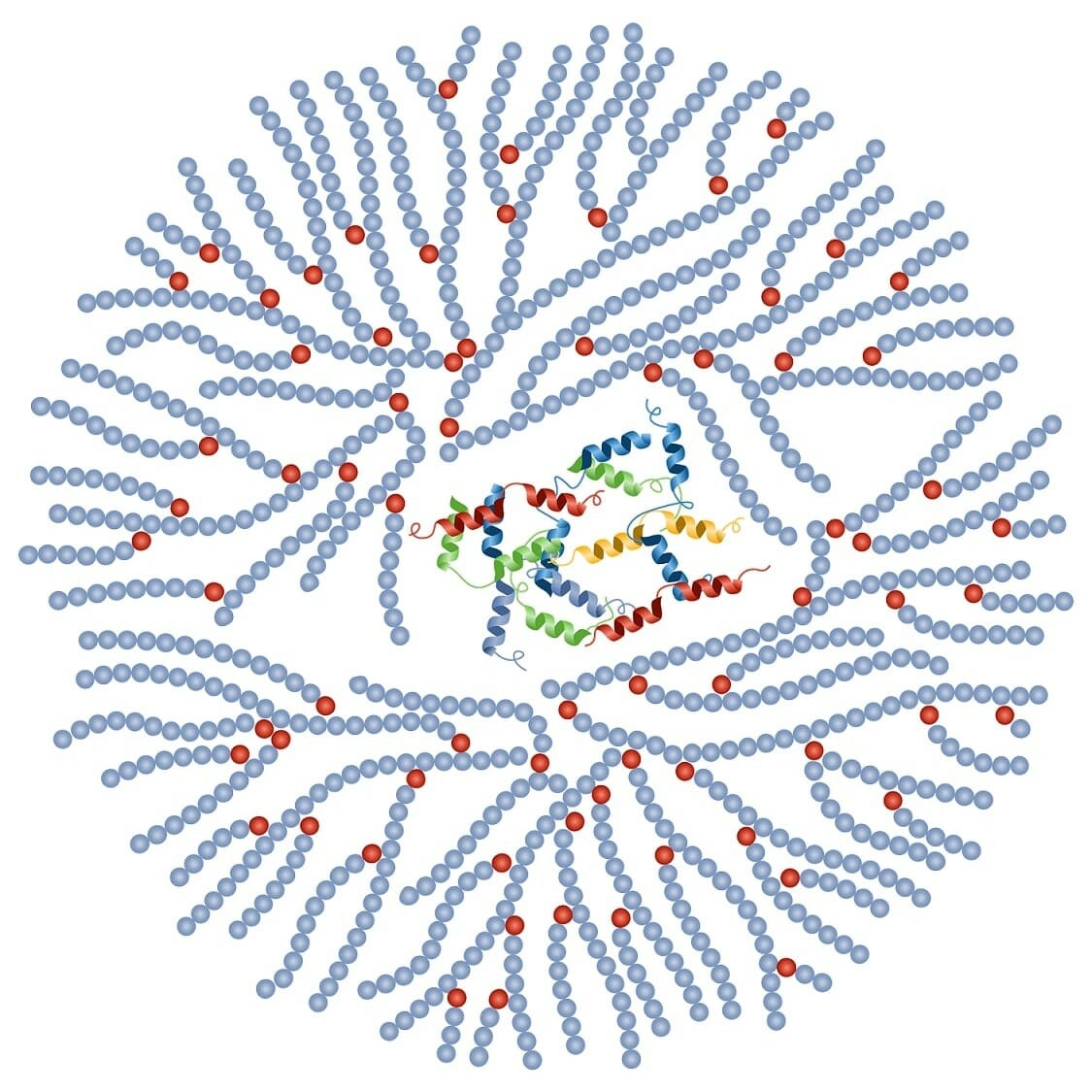
Estrutura do glicogénio:
O glicogénio consiste numa proteína central e está rodeado por 30.000–50.000 unidades de glucose.
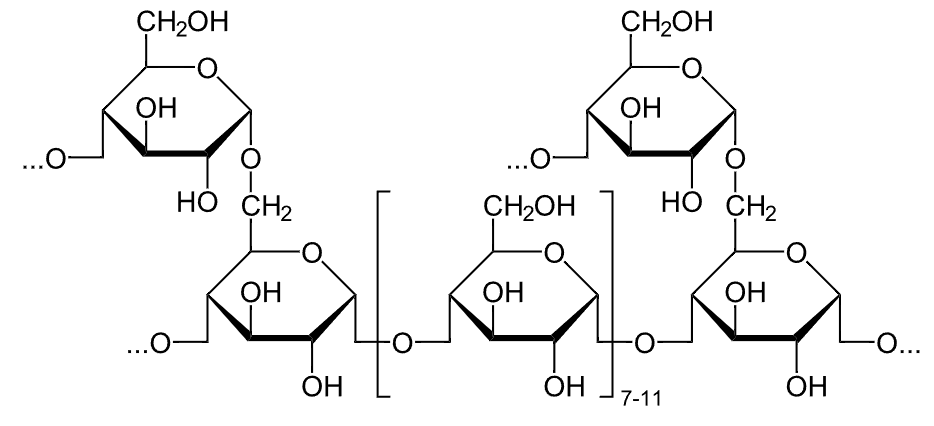
Estrutura química do glicogénio
Imagem: “Glykogen” por NEUROtiker. Licença: Public Domain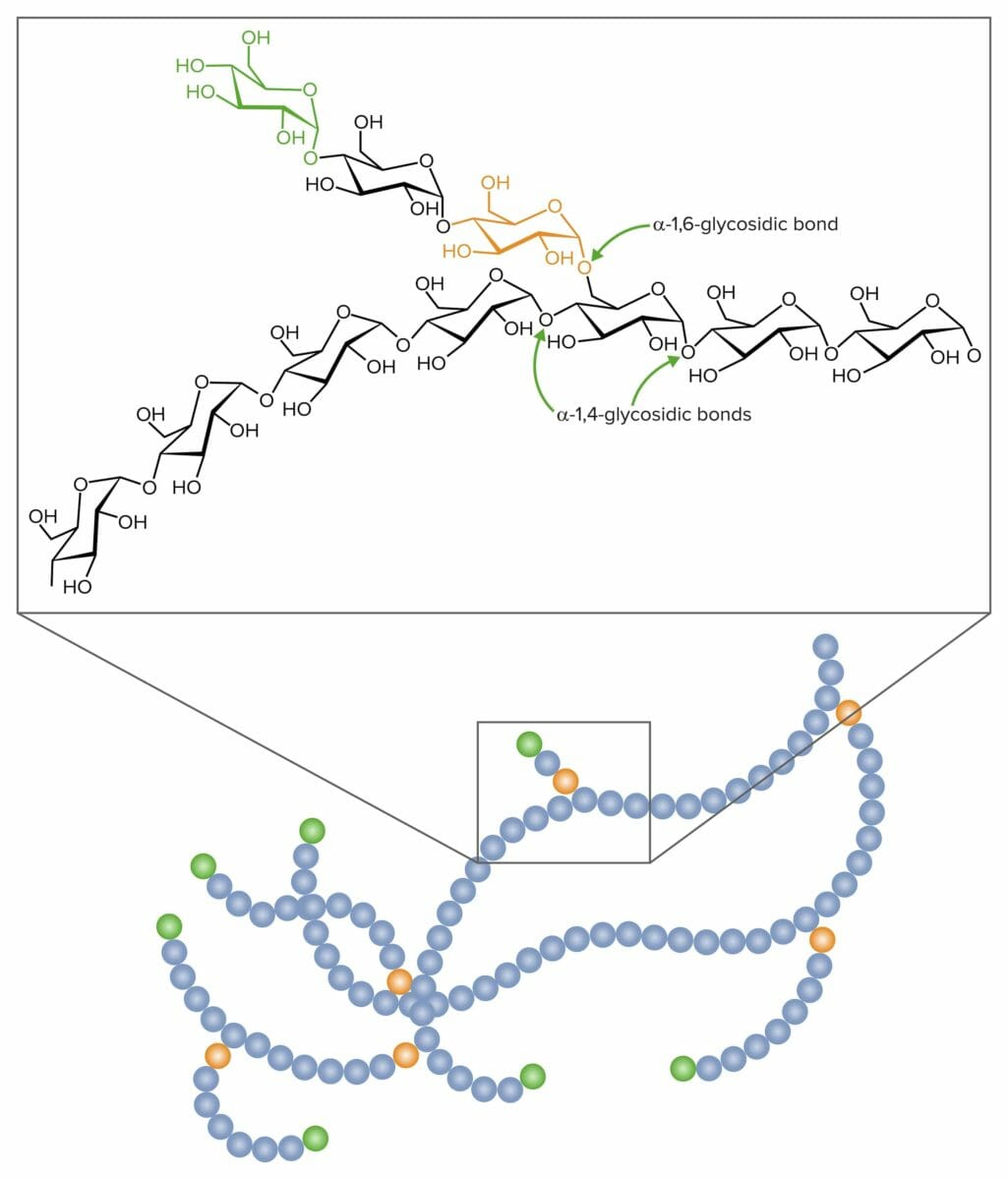
Ligações glicosídicas na formação do glicogénio:
Ligações glicosídicas alfa-1,4 e alfa-1,6
Existem 2 principais vias metabólicas do glicogénio:
Isomerização de glucose-6-fosfato em glucose-1-fosfato
Reação de glucose-1-fosfato com uridina trifosfato (UTP) para formar uma forma ativada de glucose Glucose A primary source of energy for living organisms. It is naturally occurring and is found in fruits and other parts of plants in its free state. It is used therapeutically in fluid and nutrient replacement. Lactose Intolerance:
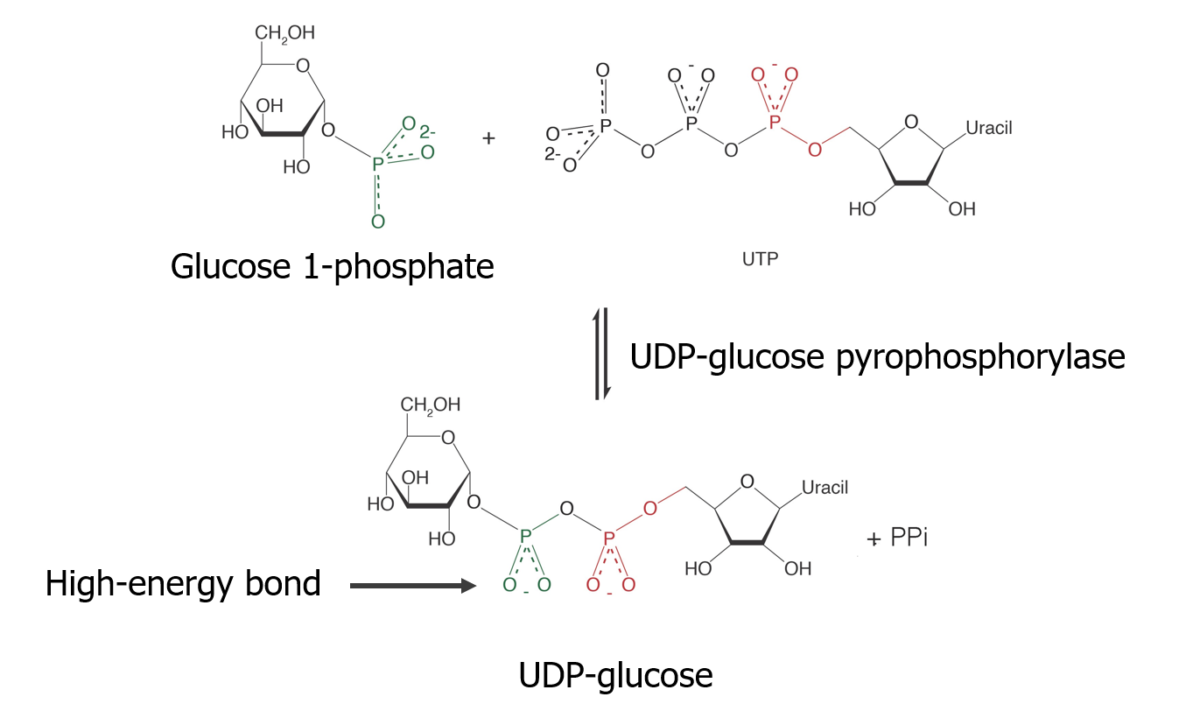
Síntese de glicogénio — Fazendo o substrato:
Formação de UDP-glicose, que está numa forma ativa na glicogénese
Formação da ligação glicosídica
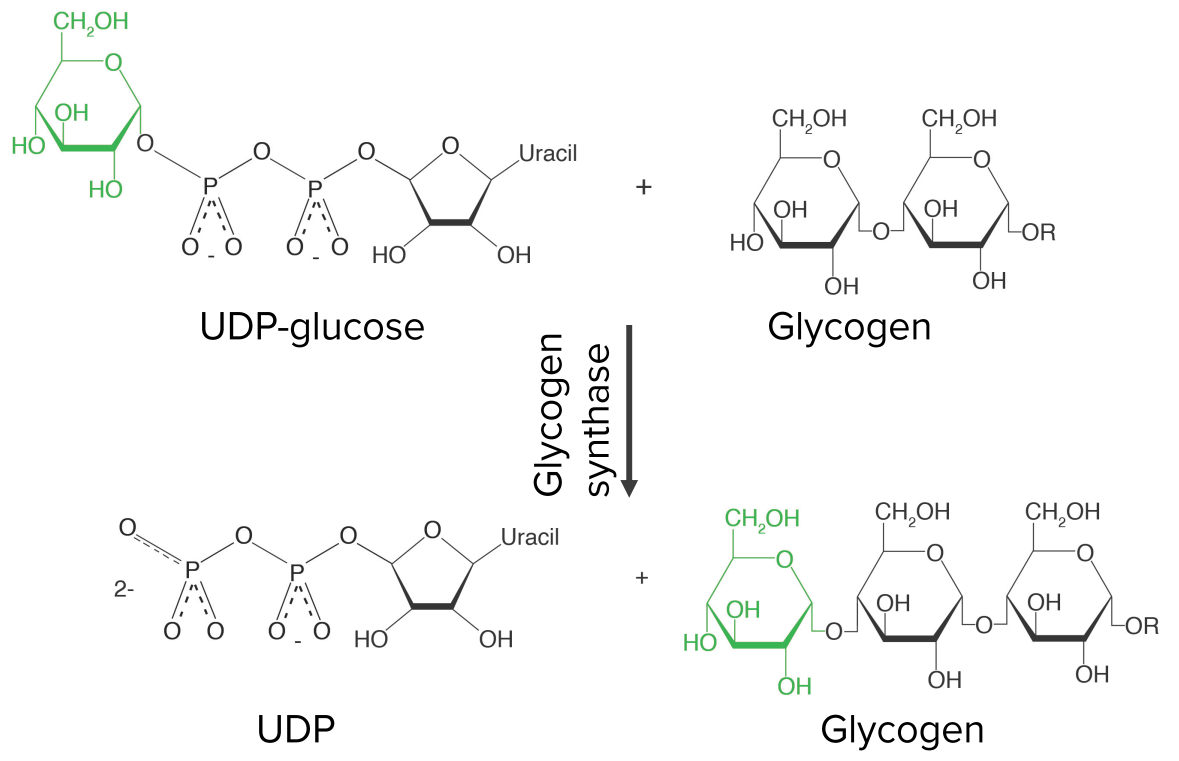
Crescimento da cadeia de glicogénio — etapa 3 da glicogénese:
A uridina difosfato glucose (UDP-glicose) é ligada ao grupo hidroxilo de uma cadeia de glicogénio já existente, libertando UDP no processo. A reação é catalisada pela glicogénio sintase, a principal enzima reguladora da glicogénese.
Ramificação do glicogénio:
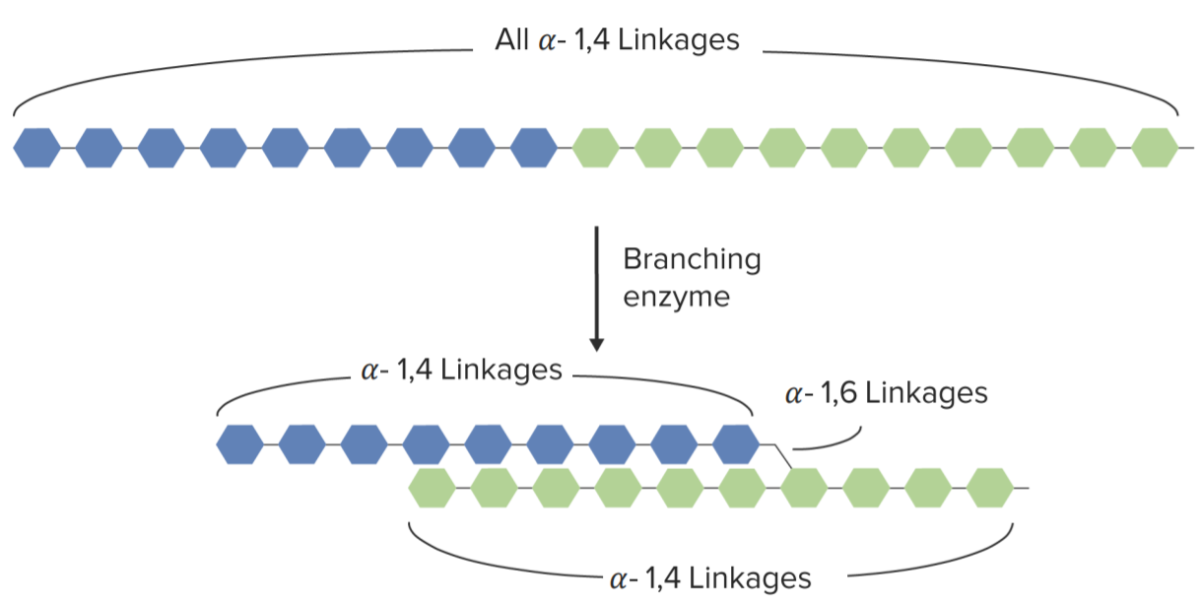
Ramificação da cadeia de glicogénio mediada pela enzima de ramificação
Imagem por Lecturio.Quebra de glicogénio para libertar energia entre as refeições ou após o esgotamento da glucose Glucose A primary source of energy for living organisms. It is naturally occurring and is found in fruits and other parts of plants in its free state. It is used therapeutically in fluid and nutrient replacement. Lactose Intolerance
Quebra de glicogénio em glucose-1-fosfato:
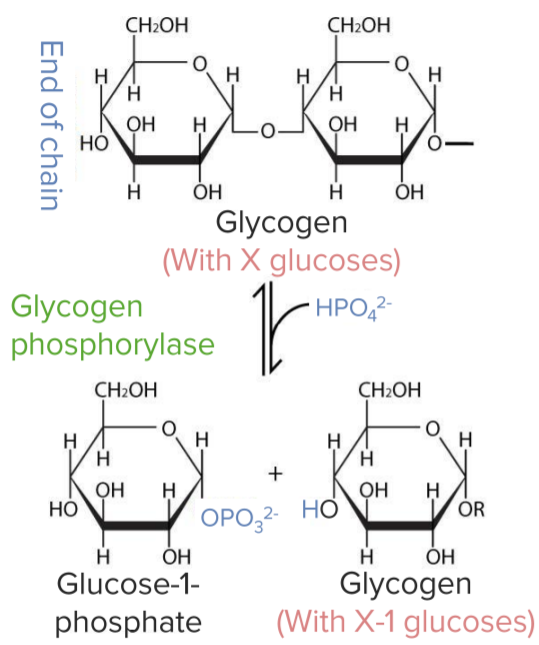
Quebra de glicogénio:
Conversão de glicogénio em glucose-1-fosfato pela enzima glicogénio fosforilase
Remoção de ligações glicosídicas alfa-1,6 (ramificações):
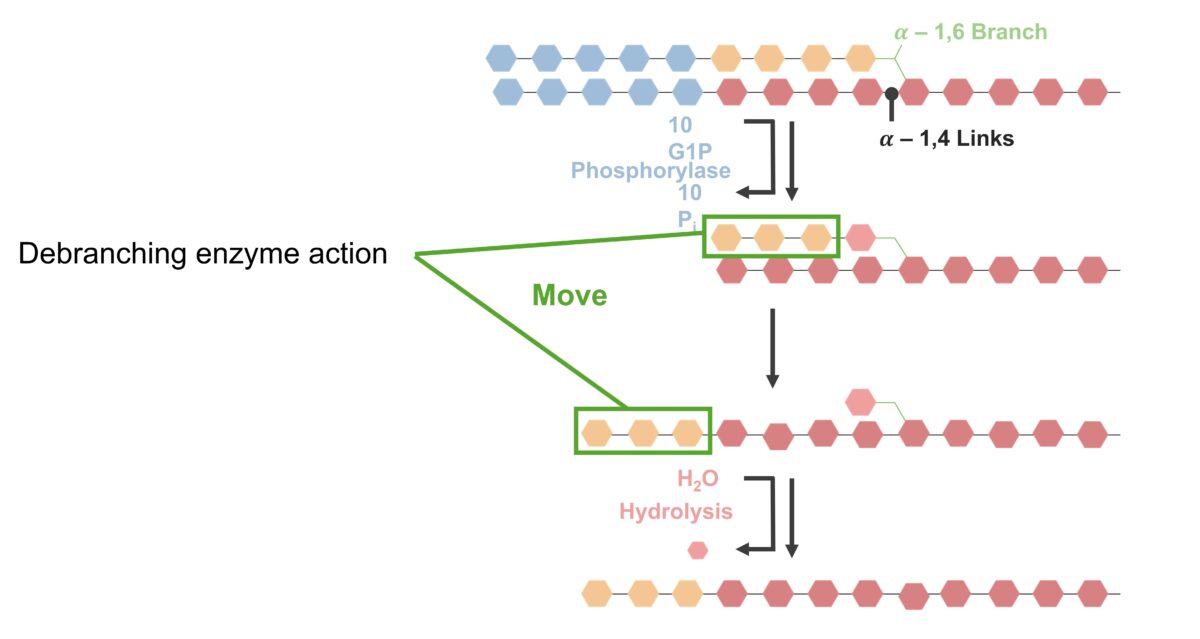
Glicogenólise (quebra de ligações e desramificação):
As ligações alfa-1,4-glicosídicas são quebradas na extremidade terminal, catalisadas pela fosforilase. As ligações entre os resíduos de glucose (azul) são hidrolisadas, libertando glucose-1-fosfato. A fosforilase hidrolisa as ligações alfa-1,4-glicosídicas até que apenas 4 resíduos de glucose (laranja) sobrem antes da ramificação alfa-1,6. A enzima desramificadora (com atividade de transferase e glicosidase) atua sobre os restantes resíduos ligados. Três dos 4 resíduos de glucose (laranja) são removidos, deixando 1 molécula. A cadeia da molécula de 3-glucose (da ramificação) é reconectada à extremidade não redutora da cadeia linear, catalisada pela glucano transferase. A única molécula restante (na ramificação) é removida pela alfa-1,6 glucosidase por hidrólise, libertando a glucose-1-fosfato. O processo de fosforilase / desramificação repete-se para gerar glucose-1-fosfato para uso de energia.
Conversão da glucose-1-fosfato libertada em glucose-6-fosfato:
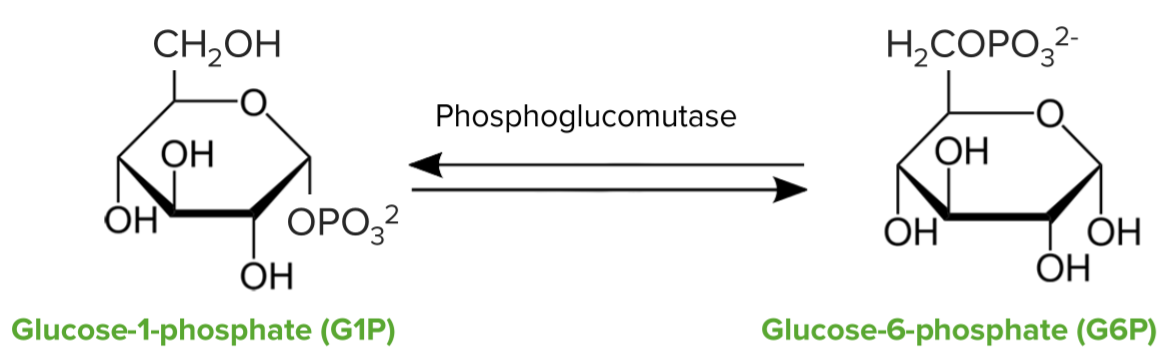
Quebra de glicogénio—glicogénio fosforilase:
Conversão de glucose-1-fosfato em glucose-6-fosfato pela enzima fosfoglucomutase
O glucagon Glucagon A 29-amino acid pancreatic peptide derived from proglucagon which is also the precursor of intestinal glucagon-like peptides. Glucagon is secreted by pancreatic alpha cells and plays an important role in regulation of blood glucose concentration, ketone metabolism, and several other biochemical and physiological processes. Gastrointestinal Secretions e a epinefrina ativam a adenilato ciclase na membrana celular através de proteínas G.
| Hormona | Glicogénese | Glicogenólise | Glucose Glucose A primary source of energy for living organisms. It is naturally occurring and is found in fruits and other parts of plants in its free state. It is used therapeutically in fluid and nutrient replacement. Lactose Intolerance no Soro |
|---|---|---|---|
| Insulina | Ativação | Inibição | Diminui |
| Glucagon Glucagon A 29-amino acid pancreatic peptide derived from proglucagon which is also the precursor of intestinal glucagon-like peptides. Glucagon is secreted by pancreatic alpha cells and plays an important role in regulation of blood glucose concentration, ketone metabolism, and several other biochemical and physiological processes. Gastrointestinal Secretions | Inibição | Ativação | Aumenta |
| Epinefrina | Inibição | Ativação | Aumenta |
| Efetores | Glicogenólise | Glicogénese |
|---|---|---|
| cAMP cAMP An adenine nucleotide containing one phosphate group which is esterified to both the 3′- and 5′-positions of the sugar moiety. It is a second messenger and a key intracellular regulator, functioning as a mediator of activity for a number of hormones, including epinephrine, glucagon, and acth. Phosphodiesterase Inhibitors | ↑ | ↓ |
| PK | ↑ | ↓ |
| AMP (músculo) | ↑ | ↓ |
| Cálcio/contração muscular | ↑ | ↓ |
| Hormonas | Glicogenólise | Glicogénese |
|---|---|---|
| Insulina | ↓ | ↑ |
| Glucagon Glucagon A 29-amino acid pancreatic peptide derived from proglucagon which is also the precursor of intestinal glucagon-like peptides. Glucagon is secreted by pancreatic alpha cells and plays an important role in regulation of blood glucose concentration, ketone metabolism, and several other biochemical and physiological processes. Gastrointestinal Secretions | ↑ | ↓ |
| Epinefrina | ↑ | ↓ |
| Enzima Reguladora | Glicogenólise | Glicogénese |
|---|---|---|
| Glicogénio sintase | Ativada (a enzima é fosforilada) | Inativada |
| Glicogénio sintase | Inativada | Ativada (a enzima é desfosforilada) |
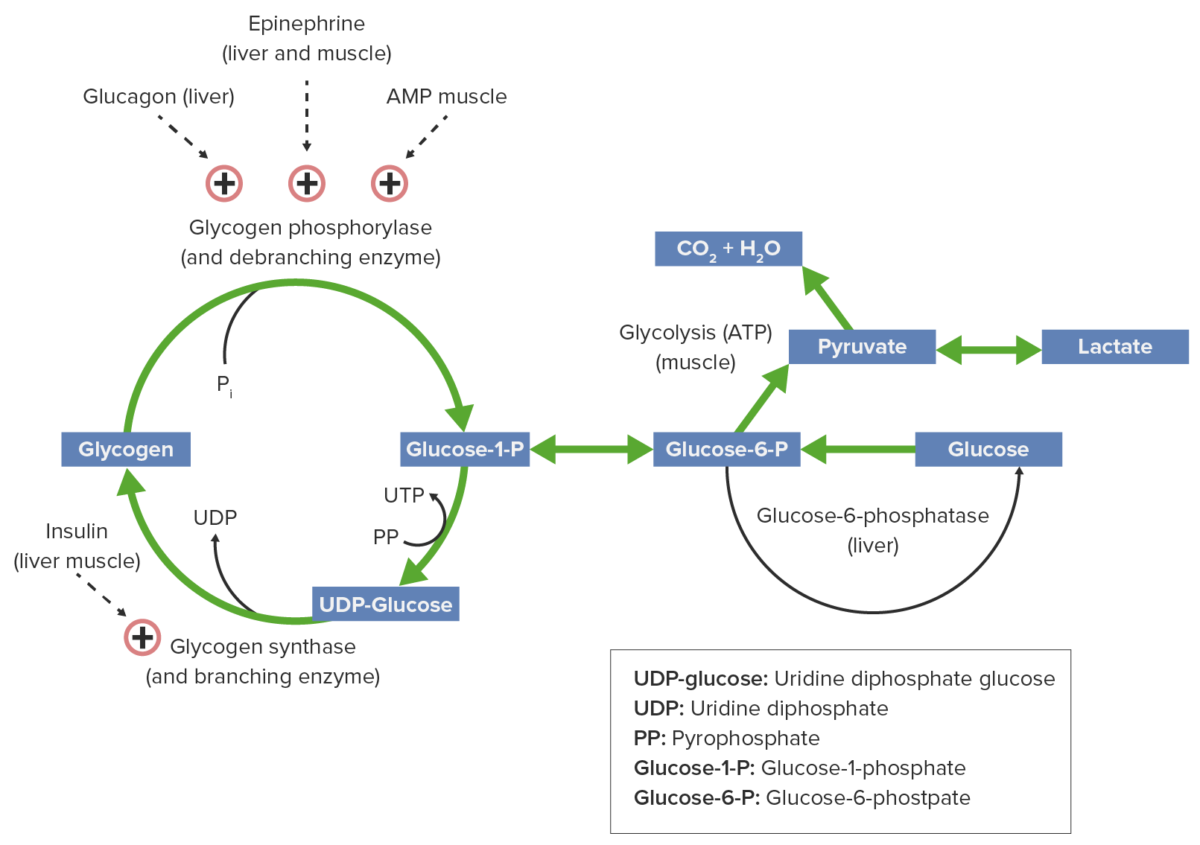
Metabolismo do glicogénio e fatores regulatórios:
A epinefrina, o glucagon e o AMP ativam a glicogénio fosforilase, promovendo assim a glicogenólise, produzindo glucose para consumo energético. A insulina ativa a glicogénio sintase, o que facilita a acumulação de glicogénio.
Doença de armazenamento de glicogénio: um grupo de doenças hereditárias caracterizadas por anormalidades no metabolismo do glicogénio, resultando numa acumulação anormal de glicogénio nos tecidos.
| Tipo | Doenças | Deficiência Enzimática | Características Clínicas |
|---|---|---|---|
| 0 | Doença de Lewis | Glicogénio sintase |
|
| Ⅰ | Doença de von Gierke | Glucose-6-fosfatase |
|
| Ⅱ | Doença de Pompe | Lisossomal α-1,4 e α-1,6 glucosidase ( maltase Maltase Digestion and Absorption of Carbohydrates ácida) |
|
| Ⅲ | Doença de Forbes-Cori | Enzima de desramificação (amilo-1,6-glucosidase) |
|
| Ⅳ | Doença de Andersen | Enzima ramificadora de 1,4 -α – glucano |
|
| Ⅴ | Doença de McArdle | Fosforilase muscular |
|
| Ⅵ | Doença de Hers | Fosforilase hepática |
|
| Ⅶ | Doença de Tarui | Fosfofrutocinase (PFK) muscular |
|
| Ⅷ | Deficiência de fosforilase cinase hepática | Fosforilase cinase hepática |
|
| Ⅸ | Deficiência de fosforilase quinase | Fosforilase cinase do fígado e do músculo |
|
| Ⅹ | Deficiência de PGAM | Fosfoglicerato mutase |
|
| ⅩⅠ | Deficiência de lactato desidrogenase A | Lactato desidrogenase A |
|
| XII | Deficiência de aldolase Aldolase Becker Muscular Dystrophy A | Aldolase Aldolase Becker Muscular Dystrophy A |
|
| XIII | Deficiência de beta-enolase (músculo) | Beta-enolase |
|
| XIV | Deficiência de fosfoglucomutase I (músculo) | Fosfoglucomutase I |
|
| XV | Deficiência de glicogenina I (músculo) | Glicogenina I |
|
| Síndrome de Fanconi-Bickel | GLUT2 GLUT2 A glucose transport facilitator that is expressed primarily in pancreatic beta cells; liver; and kidneys. It may function as a glucose sensor to regulate insulin release and glucose homeostasis. Digestion and Absorption |
|