Os linfomas não Hodgkin (LNHs) são um grupo diversificado de neoplasias hematológicas que são distúrbios proliferativos clonais de células B maduras ou progenitoras, células T ou células natural killer (NK). A maioria dos casos pediátricos é agressivo e de alto grau (mas curável); em adultos, os subtipos de baixo grau são mais comuns. Tal como o Linfoma de Hodgkin, que tem características patológicas e tratamentos distintos, o LNH geralmente apresenta sinais constitucionais de febre, sudorese noturna e perda de peso. As características clínicas incluem linfadenopatia e hepatoesplenomegalia, mas alguns indivíduos apresentam envolvimento extranodal e achados laboratoriais. Os LNH de células B incluem o linfoma difuso de grandes células B, o linfoma folicular, o linfoma de Burkitt, o linfoma de células do manto e o linfoma da zona marginal. Os LNH de células T incluem o linfoma de células T adultas e a micose fungoide. O diagnóstico é feito por biópsia ganglionar, biópsia da medula óssea ou ambas. O tratamento é realizado com quimioterapia ou fármacos dirigidos. A radioterapia é usada em adultos, mas não em crianças, e o transplante de células estaminais é usado em doentes com doença agressiva.
Última atualização: Aug 1, 2022
Os linfomas não Hodgkin (LNHs) são um grupo diversificado de neoplasias hematológicas que são distúrbios proliferativos clonais de células B maduras ou progenitoras, células T ou células natural killer (NK).
A patogénese do LNH envolve múltiplas lesões genéticas que afetam proto-oncogenes e genes supressores tumorais. As células alteradas também parecem escapar da vigilância imunológica.
A maioria dos linfomas apresenta linfadenopatia indolor com envolvimento variável do sangue periférico, medula óssea, GI, pele ou SNC.
O diagnóstico adequado requer exame histológico, imunofenotipagem, genotipagem e avaliação das características clínicas. O estadiamento é semelhante ao do linfoma de Hodgkin.
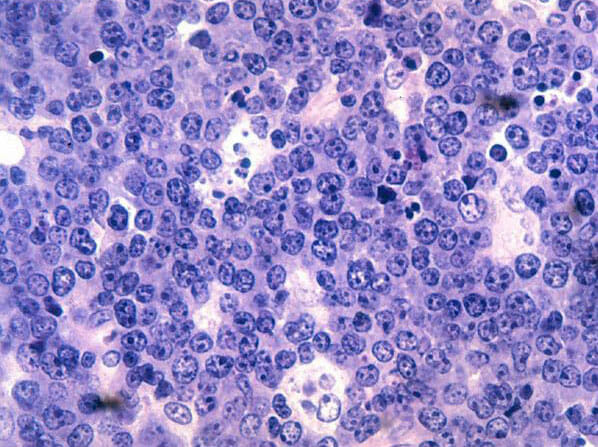
Histopatologia do linfoma de Burkitt:
Vê-se linfócitos B malignos. Note-se o aspeto clássico em “céu estrelado” transmitido por muitos macrófagos aumentados e pálidos que fagocitaram células tumorais apoptóticas mortas (pequenos fragmentos azuis/púrpura) neste tumor que se divide muito rapidamente. Coloração de H&E.
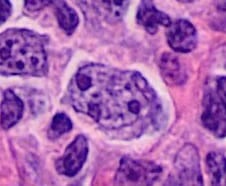
Histopatologia de um centroblasto (célula maior contendo núcleos vesiculares com 1-3 núcleos basofílicos junto à membrana nuclear) num linfoma folicular
Imagem: “Histopathology of a centroblast in follicular lymphoma” por Mikael Häggström, M.D. Licença: Public Domain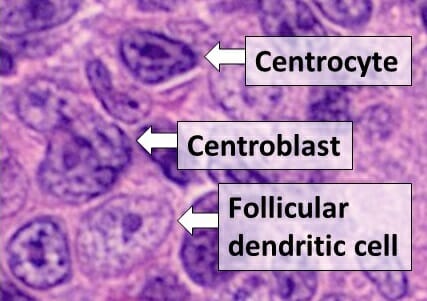
Histologia de tipos celulares num centro germinativo, visto no linfoma folicular, com centrócitos, centroblastos e uma célula dendrítica folicular
Imagem: “Centrocyte, centroblast and follicular dendritic cell in a follicular_lymphoma” por Mikael Häggström, M.D. Licença: Public Domain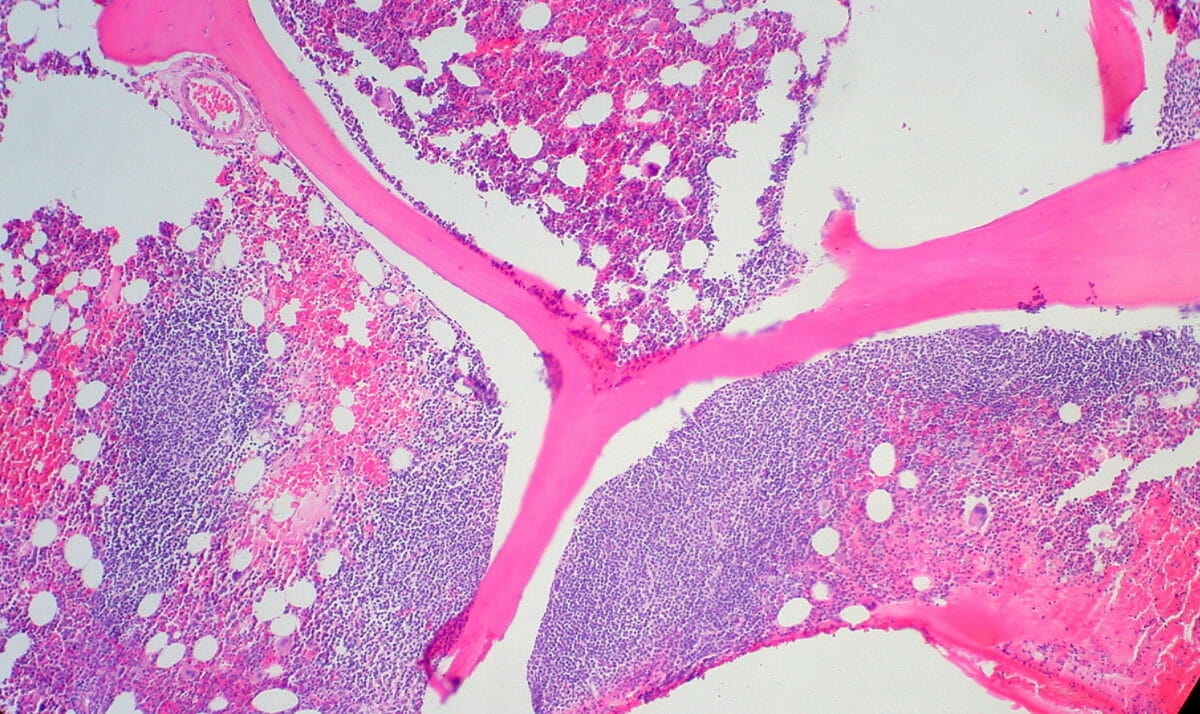
Biopsia de medula óssea de um homem de 34 anos com linfoma folicular que mostra um infiltrado paratrabecular característico
Imagem: “Follicular Lymphoma in Bone Marrow” por Ed Uthman. Licença: CC BY 2.0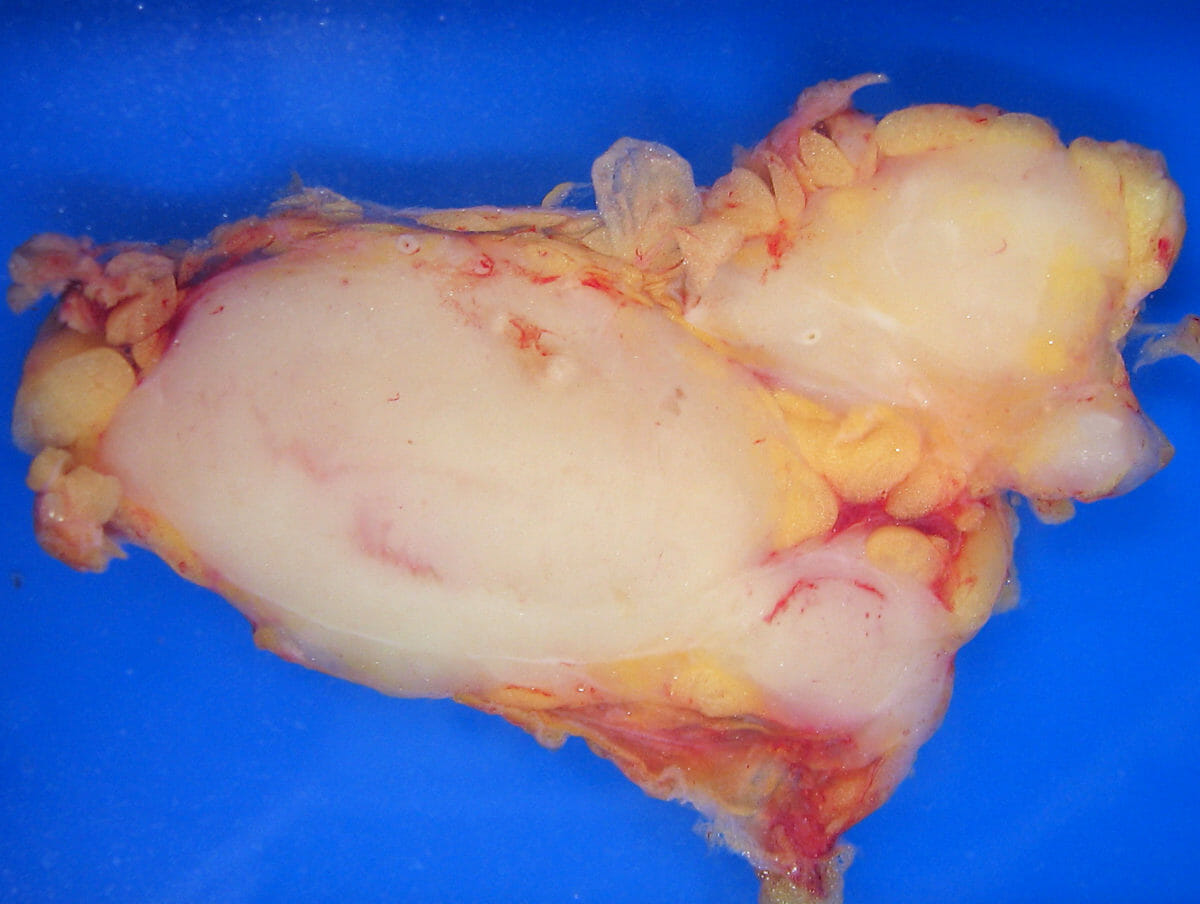
Patologia macroscópica de um linfoma folicular num gânglio linfático
Imagem: “Lymphoma_macro” por Emmanuelm. Licença: CC BY 3.0| Estádio I | Envolvimento de um único grupo de gânglios ou de um único órgão extralinfático |
|---|---|
| Estádio II | Envolvimento de ≥ 2 grupos de gânglios do mesmo lado do diafragma |
| Estádio III | Envolvimento de gânglios, baço ou ambos, em ambos os lados do diafragma |
| Estádio IV | Envolvimento difuso ou disseminado de ≥ 1 órgão extralinfático (fígado, medula óssea, pulmão) com ou sem envolvimento de gânglios |
O tratamento é baseado em muitos fatores, incluindo subtipo histológico, estádio e comorbilidades. O CD19 está altamente expresso em quase todas as neoplasias de células B, tornando-se um recetor atraente para novas terapiêuticas direcionadas.
Os LNH de alto grau são agressivos, mas têm um prognóstico melhor, enquanto que os LNH de baixo grau progridem lentamente, mas são difíceis de curar.
Os fatores do International Prognostic Index (IPI) estão associados a um pior prognóstico:
Sobrevida global em 5 anos dos LNHs como um grupo:
| Origem | Tipo | Fatores de risco e genética | Epidemiologia | Patologia e características clínicas |
|---|---|---|---|---|
| Célula B (85%–90%) | DLBCL | Surge esporadicamente ou a partir da transformação de um linfoma de baixo grau (e.g., linfoma folicular) |
|
|
| Linfoma folicular | t(14;18) → superexpressão de BCL2 (gene que regula a apoptose) |
|
|
|
| Linfoma de Burkitt |
|
|
|
|
| Linfoma de células do manto | t(11;14) → superexpressão de ciclina D1 |
|
|
|
| MZL |
|
|
|
|
| Linfoma linfoplasmocítico (macroglobulinemia de Waldenstrom) | Mutação do gene MYD88 na maioria dos casos |
|
|
|
| Célula T (10%–15%) | Linfoma de células T do adulto | Associado ao retrovírus HTLV-1 |
|
|
| Micose fungoide (linfoma cutâneo de células T) |
|
|
|