Os linfócitos são leucócitos heterogéneos envolvidos na resposta imune. Os linfócitos desenvolvem-se na medula óssea, a partir de células estaminais hematopoiéticas (HSCs, pela sigla em inglês) e progredem para progenitores linfoides comuns ( CLPs CLPs Stem cells from which B-lymphocytes; T-lymphocytes; natural killer cells; and some dendritic cells derive. Bone Marrow: Composition and Hematopoiesis, pela sigla em inglês). Os linfócitos B e T e as células natural killer (NK) surgem desta linhagem. Os linfócitos B e T desempenham um papel na imunidade adaptativa e as células NK fornecem defesa do hospedeiro contra proteínas atípicas, como células tumorais. Embora todos os estaios de desenvolvimento comecem na medula óssea, a maturação dos linfócitos é diferente. Os linfócitos B e as células NK diferenciam-se na medula óssea antes de migrar para os órgãos linfoides secundários (como os gânglios linfáticos). Os linfócitos T, no entanto, seguem para o timo para posterior maturação.
Last updated: Dec 18, 2025
Os linfócitos são células sanguíneas envolvidas na resposta imune, que surgem do progenitor linfoide comum (CLP, pela sigla em inglês).
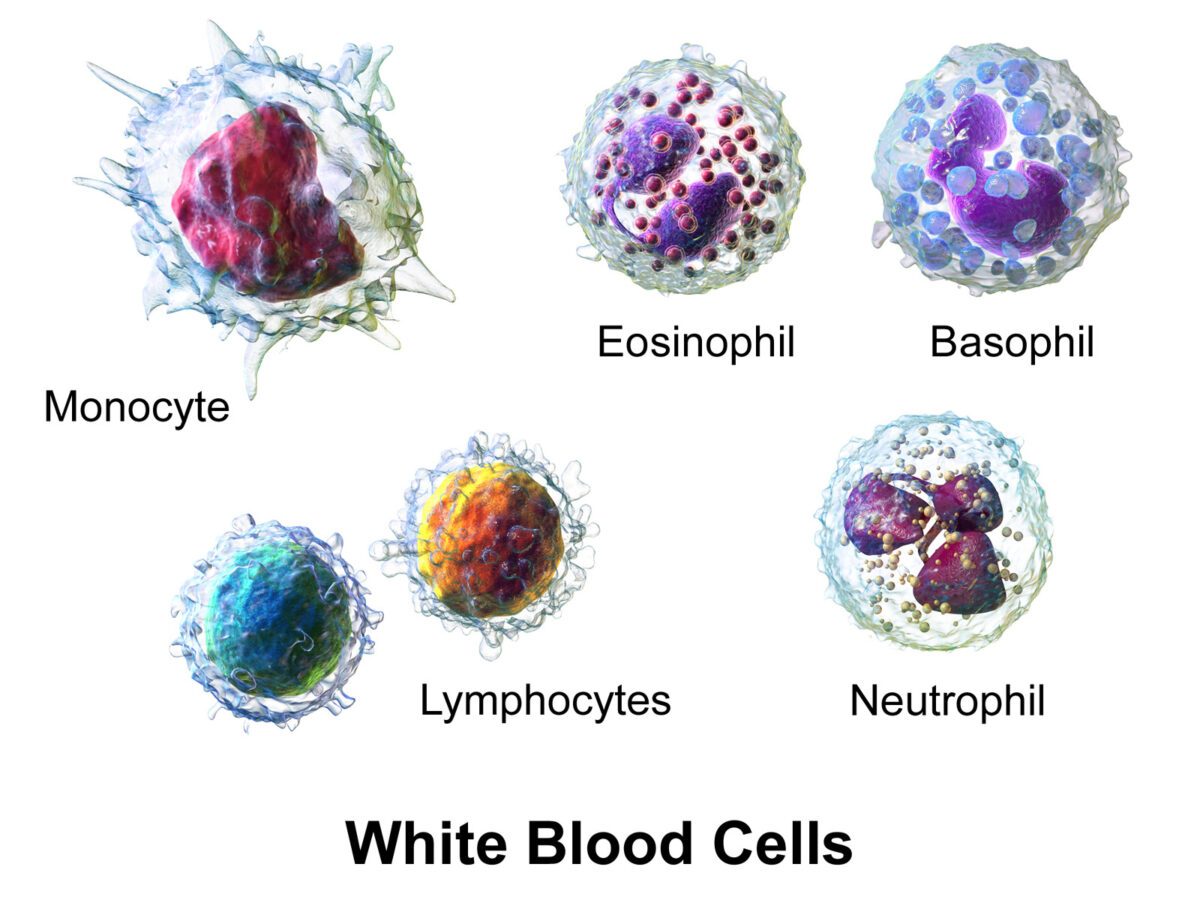
Glóbulos brancos (WBCs, pela sigla em inglês), ou leucócitos, no sangue:
Os granulócitos incluem basófilos, eosinófilos e neutrófilos; os agranulócitos incluem linfócitos e monócitos.
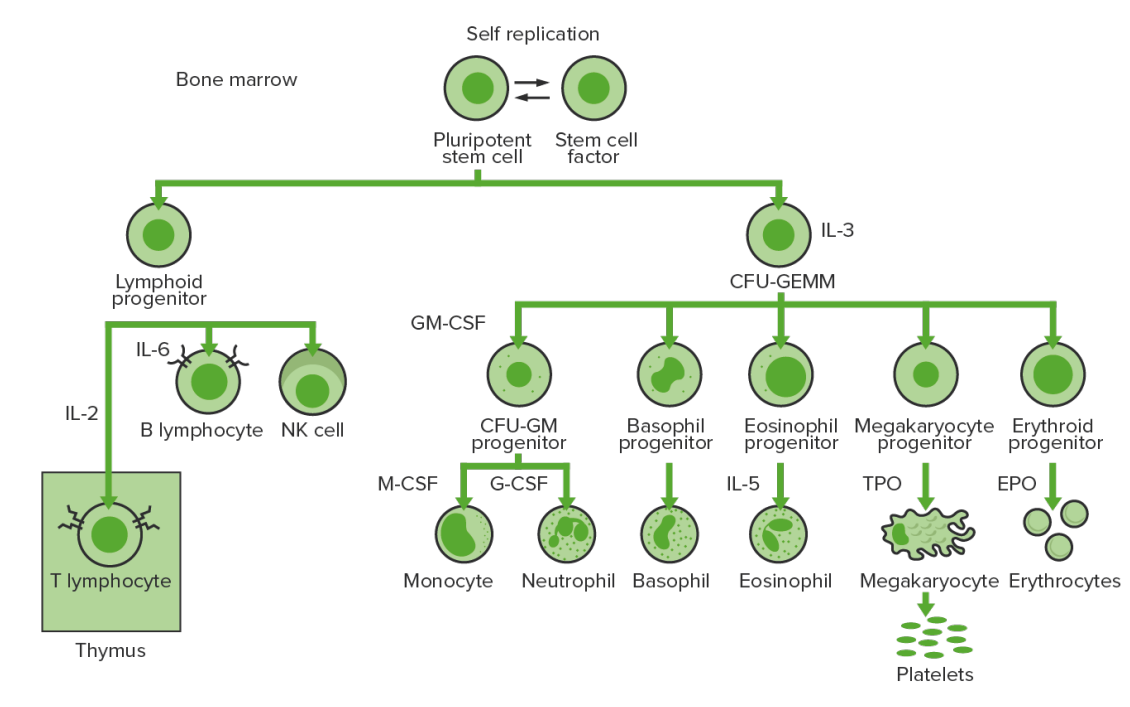
Hematopoiese da medula óssea: proliferação e diferenciação dos elementos formados de sangue.
IL-3: interleucina-3
CFU-GEMM: unidade formadora de colónias de granulócitos, eritrócitos, monócitos, megacariócitos
IL-2: interleucina-2
IL-6: interleucina-6
CFU-GM: unidade formadora de colónias granulócitos-macrófagos
GM-CSF: fator estimulador de colónias de granulócitos-macrófagos
M-CSF: fator estimulador de colónias de macrófagos
G-CSF: fator estimulador de colónias de granulócitos
IL-5: interleucina-5
NK: “natural killer”
TPO: trombopoietina
EPO: eritropoietina
| Citocinas | Atividades | Origem |
|---|---|---|
| Fator de células estaminais (SCF, pela sigla em inglês) | Estimula todas as células progenitoras hematopoiéticas | Células estromais da medula óssea |
| Interleucina-2 (IL-2) |
|
Células T auxiliares |
| Interleucina-4 (IL-4) |
|
Células T auxiliares |
| Interleucina-6 (IL-6) |
|
|
| Interleucina-7 ( IL-7 IL-7 A proinflammatory cytokine produced primarily by T-lymphocytes or their precursors. Several subtypes of interleukin-17 have been identified, each of which is a product of a unique gene. Severe Combined Immunodeficiency (SCID)) | Estimulação de todas as células estaminais linfoides | Células estromais da medula óssea |
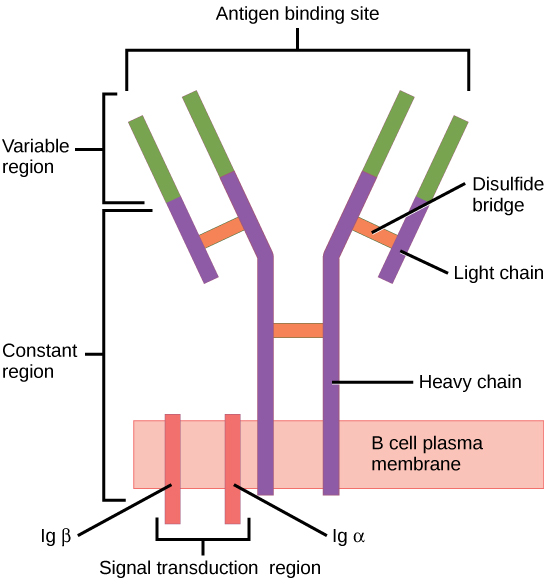
O recetor de células B (BCR, pela sigla em inglês) consiste na molécula de imunoglobulina (Ig) e na molécula de sinalização. A imunoglobina contém 2 cadeias pesadas idênticas e 2 cadeias leves idênticas ligadas por uma ponte dissulfeto; a Ig ligada à membrana é ancorada à superfície da célula.
Imagem: “Figure 42 02 06” por OpenStax. Licença: CC BY 4.0Para atingir a funcionalidade, a célula B passa por etapas na medula óssea e nos órgãos linfoides secundários.
| Estadio de maturação | Genes Genes A category of nucleic acid sequences that function as units of heredity and which code for the basic instructions for the development, reproduction, and maintenance of organisms. DNA Types and Structure Ig Ig X-linked Agammaglobulinemia | BCR BCR Lymphocytes: Histology | Eventos associados |
|---|---|---|---|
| Célula Pré-pro-B | DNA DNA A deoxyribonucleotide polymer that is the primary genetic material of all cells. Eukaryotic and prokaryotic organisms normally contain DNA in a double-stranded state, yet several important biological processes transiently involve single-stranded regions. DNA, which consists of a polysugar-phosphate backbone possessing projections of purines (adenine and guanine) and pyrimidines (thymine and cytosine), forms a double helix that is held together by hydrogen bonds between these purines and pyrimidines (adenine to thymine and guanine to cytosine). DNA Types and Structure germinativo | Nenhum | Sem expressão de cadeia pesada ou leve |
| Célula Pro-B | Rearranjo IGH D-J | Nenhum | Começa a expressar CD19, CD34 e HLA-DR (antigénio de histocompatibilidade de classe II) |
| Célula Pré-B | Rearranjo IGH V-D-J | É formado Pré-BCR:
|
Aparecem outros marcadores (por exemplo, CD79, CD10, CD20, CD40 CD40 Members of the tumor necrosis factor receptor superfamily with specificity for CD40 ligand. They are found on mature B-lymphocytes, some epithelial cells; and lymphoid dendritic cells. Evidence suggests that CD40-dependent activation of B-cells is important for generation of memory B-cells within the germinal centers. Mutations in the CD40 antigen gene result in hyper-igm immunodeficiency syndrome, type 3. Signaling of the receptor occurs through its association with tnf receptor-associated factors. Hyper-IgM Syndrome, TdT TdT Acute Lymphoblastic Leukemia) |
| Célula B imatura |
|
BCR BCR Lymphocytes: Histology maduro (molécula IgM IgM A class of immunoglobulin bearing mu chains (immunoglobulin mu-chains). Igm can fix complement. The name comes from its high molecular weight and originally being called a macroglobulin. Immunoglobulins: Types and Functions) | A expressão de HLA-DR, CD19, CD20 e CD40 CD40 Members of the tumor necrosis factor receptor superfamily with specificity for CD40 ligand. They are found on mature B-lymphocytes, some epithelial cells; and lymphoid dendritic cells. Evidence suggests that CD40-dependent activation of B-cells is important for generation of memory B-cells within the germinal centers. Mutations in the CD40 antigen gene result in hyper-igm immunodeficiency syndrome, type 3. Signaling of the receptor occurs through its association with tnf receptor-associated factors. Hyper-IgM Syndrome continua, mas não outros marcadores (por exemplo, CD10, CD34, TdT TdT Acute Lymphoblastic Leukemia) |
| Célula B madura (naive) |
|
Com BCR BCR Lymphocytes: Histology maduro ( IgM IgM A class of immunoglobulin bearing mu chains (immunoglobulin mu-chains). Igm can fix complement. The name comes from its high molecular weight and originally being called a macroglobulin. Immunoglobulins: Types and Functions) → saída da medula óssea | Expressão de CD19 e CD20 por todos |
| Estadio de maturação | BCR BCR Lymphocytes: Histology | Eventos associados |
|---|---|---|
| Célula B madura (em tecidos linfoides secundários) | Maduro (expressa IgM IgM A class of immunoglobulin bearing mu chains (immunoglobulin mu-chains). Igm can fix complement. The name comes from its high molecular weight and originally being called a macroglobulin. Immunoglobulins: Types and Functions e IgD IgD An immunoglobulin which accounts for less than 1% of plasma immunoglobulin. It is found on the membrane of many circulating B lymphocytes. Immunoglobulins: Types and Functions quando nos tecidos linfoides secundários) | As células podem descansar, ou pode ocorrer a ativação das células B (as células B interagem com o antigénio exógeno e/ou células T auxiliares). |
| Célula B ativada | Mudança de classe | Uma vez ativado, pode permanecer como IgM IgM A class of immunoglobulin bearing mu chains (immunoglobulin mu-chains). Igm can fix complement. The name comes from its high molecular weight and originally being called a macroglobulin. Immunoglobulins: Types and Functions ou mudar para IgE IgE An immunoglobulin associated with mast cells. Overexpression has been associated with allergic hypersensitivity. Immunoglobulins: Types and Functions, IgG IgG The major immunoglobulin isotype class in normal human serum. There are several isotype subclasses of igg, for example, igg1, igg2a, and igg2b. Hypersensitivity Pneumonitis ou IgA IgA Represents 15-20% of the human serum immunoglobulins, mostly as the 4-chain polymer in humans or dimer in other mammals. Secretory iga is the main immunoglobulin in secretions. Immunoglobulins: Types and Functions |
| Célula B de memória |
|
|
| Célula plasmática |
|
|
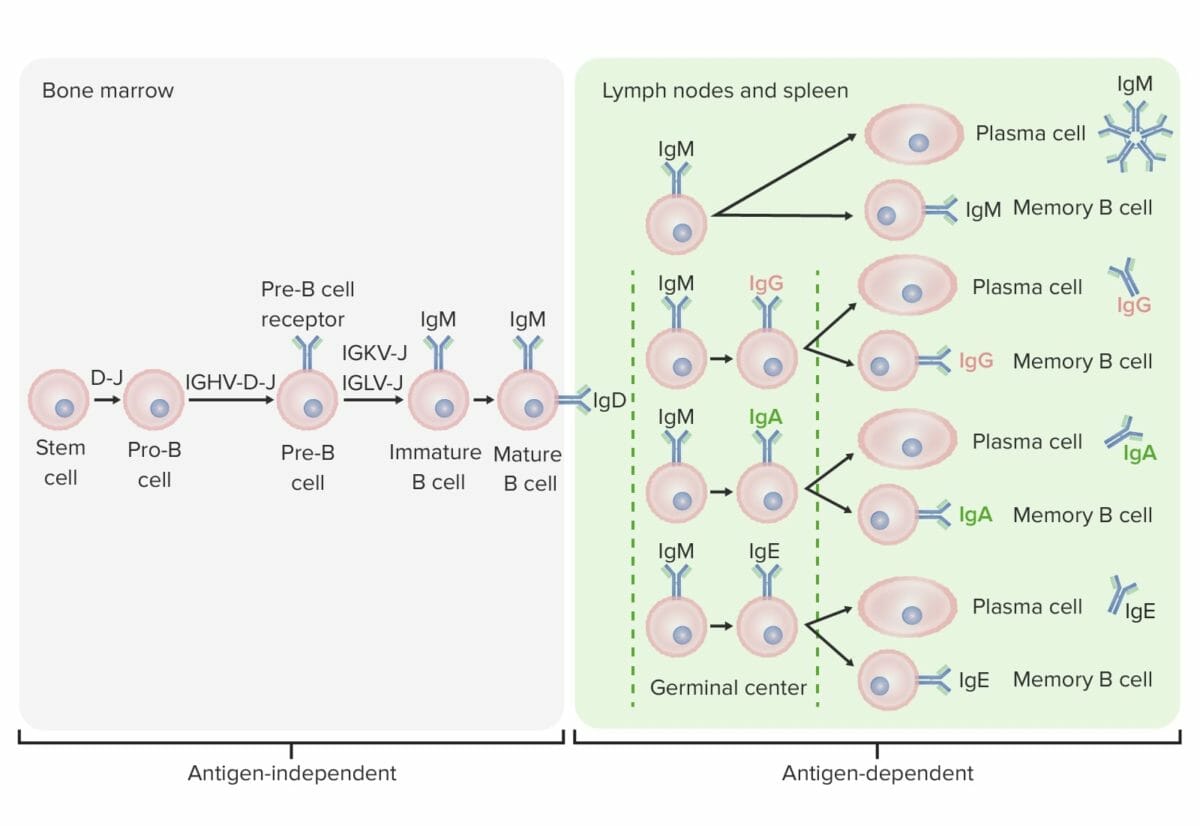
Fases de diferenciação da célula B:
Em estadios independentes de antigénio, a produção de células B começa com a célula estaminal hematopoiética (HSC, pela sigla em inglês), que se torna um progenitor linfoide comum (CLP, pela sigla em inglês), depois uma célula pré-pró-B ou célula B-progenitora. Os próximos passos incluem o rearranjo génico para montagem da molécula de imunoglobulina (Ig). As cadeias pesadas de imunoglobulinas começam com o rearranjo da diversidade e a junção de segmentos para formar a célula pró-B. Na próxima etapa (pré-célula B), é completada a recombinação da cadeia pesada de Ig (variável, diversidade, junção) e forma-se o recetor pré-célula B. O rearranjo da cadeia leve (kappa (κ) ou lambda (λ)) ocorre como resulta da expressão de uma molécula de anticorpo IgM completa por uma célula B imatura. Segue-se a formação da célula B madura (naive) com IgM e IgD.
Os estadios dependentes de antigénio ocorrem em tecidos linfoides secundários. Uma vez que a célula B madura produz IgM e IgD, pode ocorrer a mudança de classe para produzir IgE, IgG e IgA. As células B são ativadas e tornam-se células plasmáticas ou células de memória.
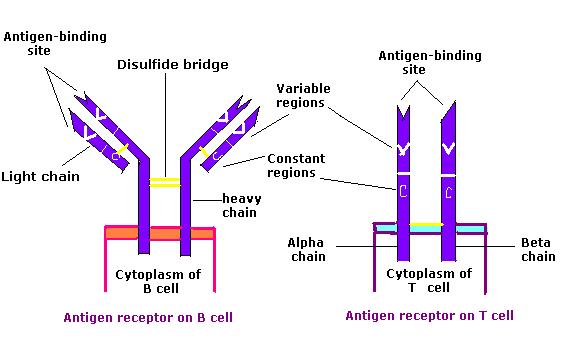
Comparação do recetor de células B (BCR, pela sigla em inglês) e do recetor de células T (TCR, pela sigla em inglês)
Imagem : “Antigen receptor chem114A” por Tinastella. Licença: Public DomainPara atingir a funcionalidade, a célula T passa por etapas, libertadas da medula óssea como células progenitoras para continuar o desenvolvimento no timo.
| Estadio de maturação | Recetor de células T | Eventos associados |
|---|---|---|
| Células progenitoras | Nenhum |
|
| Células duplamente negativas | Rearranjo da cadeia β (pré-TCR) (a falha no rearranjo leva à apoptose) |
|
| Células duplamente positivas | Rearranjo da cadeia ɑ → montagem de cadeias ɑ com cadeias β → complexo ɑ-β–TCR-CD3 completo (expresso na superfície) |
|
| Células T simples-positivas |
|
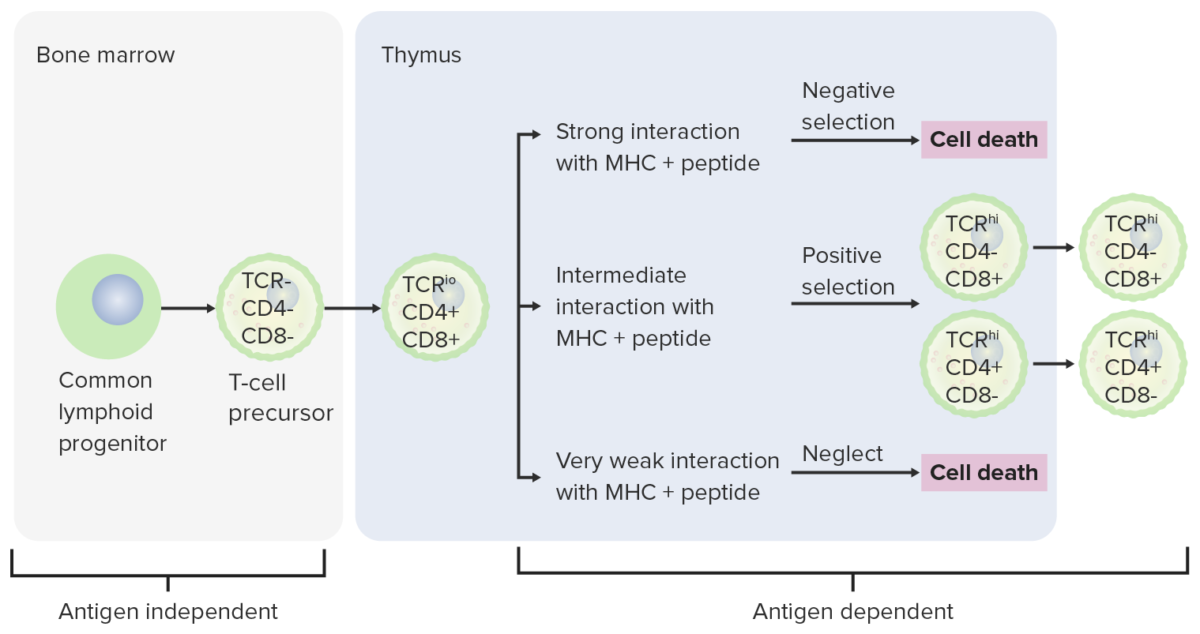
Estadios de diferenciação da célula T:
Da medula óssea, as células progenitoras vão para o timo para posterior maturação. As células duplamente negativas (sem expressão de CD4/CD8 ou CD4-/CD8 -) não desenvolveram o recetor de células T (TCR). As células duplamente negativas sofrem rearranjo do gene TCR e tornam-se células pró-T, depois células pré-T. Através da série, são expressos CD4 e CD8, e o TCR é montado por rearranjos génicos (células duplamente positivas). O timo apresenta moléculas do complexo principal de histocompatibilidade (MHC) para as células T em desenvolvimento. Algumas células sofrem seleção positiva (interação intermediária entre MHC e TCR) e produzem células funcionais. Algumas células sofrem seleção negativa (forte interação entre MHC e TCR), o que resulta em morte celular. A libertação de células T disfuncionais, que podem ativar a autoimunidade, é evitada. Algumas células T não interagem, levando à apoptose. As células T maduras expressam CD4 (células T auxiliares) ou CD8 (células T citotóxicas), mas não ambos.