A leucemia mielóide crónica (LMC) é uma proliferação maligna da linhagem celular granulocítica, caracterizada por uma diferenciação relativamente normal. A anomalia genética subjacente é o cromossoma Filadélfia, uma alteração do cromossoma 22, que resulta da translocação recíproca (9;22)(q34; q11). O cromossoma contém o gene de fusão BCR-ABL1 (ABL1 no cromossoma 9 e BCR no cromossoma 22), que induz a ativação constitutiva da tirosina quinase e, consequentemente, a produção descontrolada de granulócitos. Os doentes com LMC podem ser assintomáticos ou apresentar sintomas constitucionais, dor esternal e esplenomegalia. As análises laboratoriais revelam aumento de leucócitos e o esfregaço de sangue periférico mostra um aumento do número de células imaturas. A demonstração da translocação Filadélfia através de técnicas citogenéticas é considerada o melhor teste diagnóstico (gold standard). Sem tratamento, a LMC apresenta geralmente um curso trifásico, progredindo de uma fase crónica para uma fase acelerada e, por fim, uma crise blástica terminal. O tratamento inclui terapêutica com inibidores da tirosina quinase e agentes paliativos, bem como transplante de células hematopoéticas alogénico.
Última atualização: Mar 28, 2022
A leucemia mielóide crónica (LMC) é uma neoplasia mieloproliferativa crónica caracterizada pela proliferação descontrolada e desregulada da linhagem granulocítica (células maduras e em maturação), com capacidade de diferenciação mantida. A leucemia mielóide crónica também é conhecida como leucemia mielocítica crónica ou leucemia mielógena crónica.
A hematopoiese inicia-se com uma célula estaminal hematopoiética, estimulada a dividir-se e diferenciar-se com estímulos químicos apropriados (fatores de crescimento hemopoiéticos).
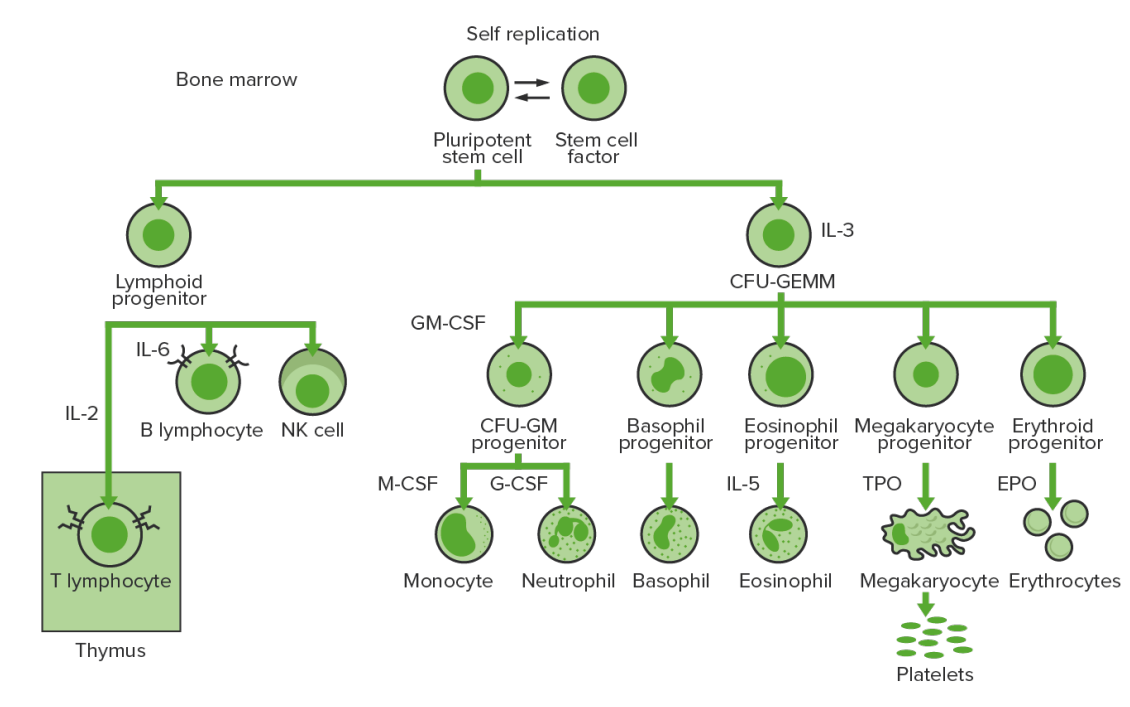
Hematopoiese da medula óssea:
Proliferação e diferenciação dos elementos sanguíneos:
Na LMC, ocorre proliferação sustentada de células da linhagem granulocítica (mieloblastos → neutrófilos, basófilos, eosinófilos). É possível observar células maduras e células em maturação; assim, existem células que são apenas parcialmente eficazes.
CFU-GEMM (pela sigla em inglês): unidade formadora de colónias de granulócitos, eritrócitos, monócitos, megacariócitos
GM-CSF (pela sigla em inglês): fator estimulador de colónias de macrófagos e granulócitos
M-CSF (pela sigla em inglês): fator estimulador de colónias de macrófagos
G-CSF (pela sigla em inglês): fator estimulador de colónias de granulócitos
NK: natural killer
A leucemia mielóide crónica é uma anomalia adquirida das células estaminais hematopoiéticas na medula óssea.
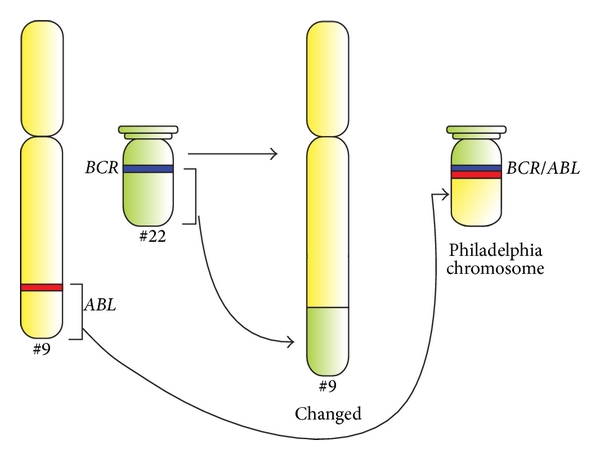
Diagrama esquemático da translocação genética característica do cromossoma Filadélfia e representação esquemática dos genes BCR e ABL.
Os genes ABL1 e BCR pertencem aos braços longos dos cromossomas 9 e 22, respetivamente. O gene de fusão BCR-ABL é formado pela translocação do gene ABL1 (do cromossoma 9) para o braço longo do cromossoma 22, criando um cromossoma 22 alterado (o chamado cromossoma Filadélfia).
Os sintomas acima descritos variam em gravidade, dependendo das 3 fases de doença da LMC (com base em leucócitos imaturos ou blastos no sangue ou medula óssea).
Fase crónica estável:
Fase acelerada:
Crise blástica (ou fase aguda):
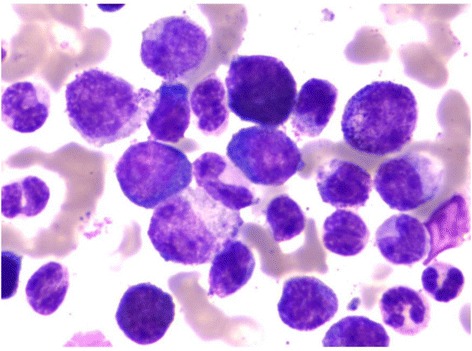
Avaliação da medula óssea:
Observam-se blastos na medula óssea de um doente com diagnóstico de LMC
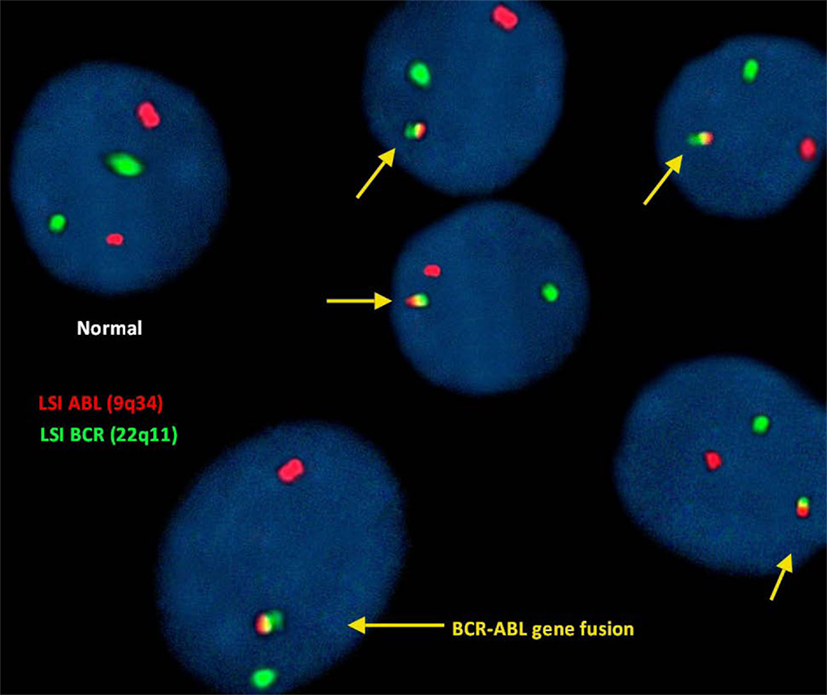
FISH para a deteção de t(9;22)(q34; q11):
Neste estudo, a análise FISH do gene ABL (9q34) foi identificada com pontos vermelhos fluorescentes e o gene BCR (22q11) com pontos verdes. Portanto, uma célula que exiba 2 pontos verdes e vermelhos separados foi considerada uma célula normal que não revela translocação.
No entanto, a translocação irregular numa célula é identificada com 1 ponto vermelho e 1 ponto verde e sinais vermelhos, amarelos e verdes fundidos (representativo da fusão do gene BCR-ABL).
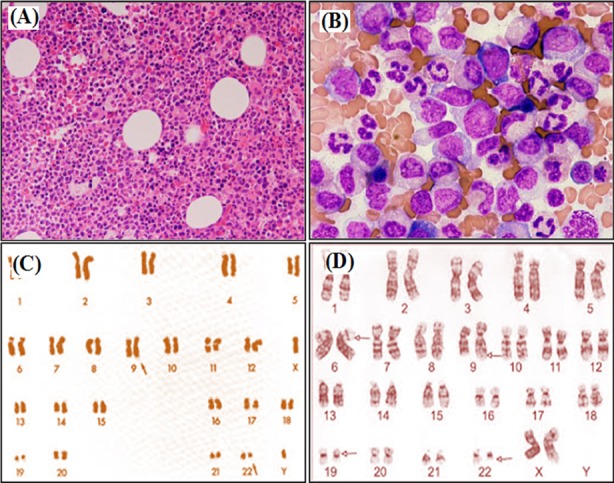
Avaliação de medula óssea e cariótipo de LMC:
Aspirado de medula óssea revela hipercelularidade
A: ampliação x100
B: ampliação x400
C: análise padrão do cariótipo do cromossoma Filadélfia (cromossoma 22 alterado)
D: LMC com envolvimento mais complexo do cromossoma 6
As neoplasias mieloproliferativas podem ser comparadas com a seguinte classificação da Organização Mundial da Saúde (OMS):
| Doença | Mutações | Pontos chave |
|---|---|---|
| LMC | BCR-ABL1 (cromossoma Filadélfia) | Proliferação de granulócitos maduros e em maturação |
| Trombocitemia essencial | JAK2, CALR ou MPL | Produção clonal excessiva de plaquetas |
| Policitemia vera | JAK2 | Aumento da massa eritróide |
| Mielofibrose primária | JAK2, CALR ou MPL | Fibrose obliterativa da medula óssea |
Outros tipos:
Fase crónica estável:
Fase acelerada:
Crise blástica: