A leucemia linfoblástica aguda/linfoma linfoblástico (LLA/LLB) são doenças hematológicas malignas caracterizadas pela proliferação descontrolada de células precursoras linfóides. A LLA/LLB, forma mais MAIS Androgen Insensitivity Syndrome comum de cancro na infância, caracteriza-se por um aumento de linfoblastos. Na LLA/LLB, os linfoblastos substituem a medula normal, podendo entrar na circulação sanguínea e infiltrar outros órgãos. A apresentação clínica inclui fadiga, hemorragia, febre e infeções, todas associadas a anemia Anemia Anemia is a condition in which individuals have low Hb levels, which can arise from various causes. Anemia is accompanied by a reduced number of RBCs and may manifest with fatigue, shortness of breath, pallor, and weakness. Subtypes are classified by the size of RBCs, chronicity, and etiology. Anemia: Overview and Types, trombocitopenia e ausência de leucócitos funcionais. Os sintomas têm início em dias a semanas. Os efeitos de massa da infiltração maligna (nos ossos, fígado, baço) são comuns; assim, é possível observar hepatoesplenomegalia e linfadenopatias. O diagnóstico é realizado através do esfregaço de sangue periférico e biópsia da medula óssea, que revela a presença de linfoblastos. A imunofenotipagem, a histoquímica e os estudos genéticos auxiliam na classificação e orientação do tratamento. Este é realizado principalmente com quimioterapia, administrada em diferentes fases (indução, consolidação e manutenção). O prognóstico é variável, conforme a idade de início e o tipo de leucemia. A taxa de cura em crianças é de 85%.
Last updated: Mar 28, 2022
A leucemia linfoblástica aguda/linfoma linfoblástico (LLA/LLB) são doenças hematológicas malignas caracterizadas pela proliferação patológica de células precursoras linfóides (principalmente as linhagens de células B e T) na medula óssea, com subsequente substituição de outros precursores de células sanguíneas.
Sistema da Organização Mundial da Saúde (OMS) 2016 (substitui a classificação francesa-americana-britânica):
A hematopoiese inicia-se com uma célula estaminal hematopoiética, estimulada a dividir-se e diferenciar-se com estímulos químicos apropriados (fatores de crescimento hematopoiéticos).
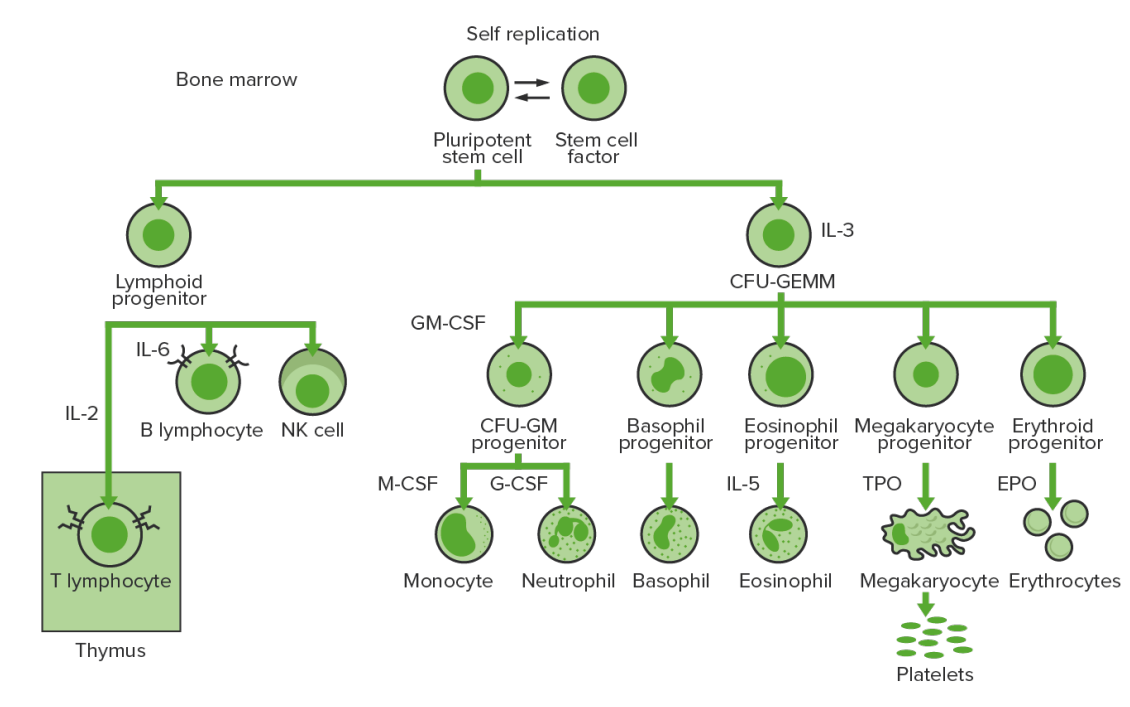
Hematopoiese da medula óssea:
Proliferação e diferenciação dos elementos sanguíneos:
Na LMC, existe uma proliferação sustentada de células da linhagem granulocítica (mieloblastos → neutrófilos, basófilos, eosinófilos). Observam-se células maduras e em maturação; assim, existem células que são apenas parcialmente eficazes.
CFU-GEMM (pela sigla em inglês): unidade formadora de colónias de granulócitos, eritrócitos, monócitos, megacariócitos
CFU-GM (pela sigla em inglês): unidade formadora de colónias de macrófagos e granulócitos
GM-CSF (pela sigla em inglês): fator estimulador de colónias de granulócitos e macrófagos
M-CSF (pela sigla em inglês): fator estimulador de colónias de macrófagos
G-CSF (pela sigla em inglês): fator estimulador de colónias de granulócitos
NK: natural killer
TPO: trombopoietina
| Características | Leucemia linfoblástica aguda | Leucemia mielóide aguda |
|---|---|---|
| População | Mais MAIS Androgen Insensitivity Syndrome comum em crianças | Mais MAIS Androgen Insensitivity Syndrome comum em adultos |
| Características comuns |
|
|
| Clínica |
|
|
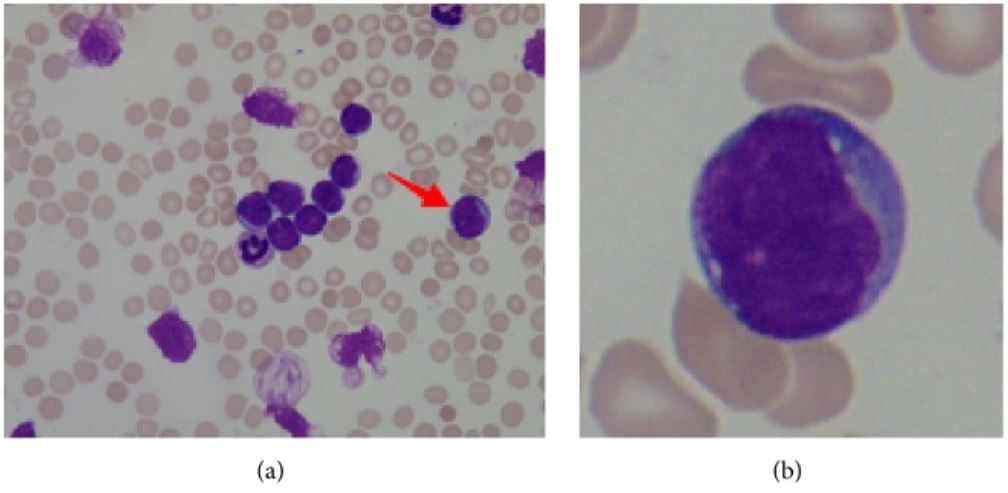
a: esfregaço de medula óssea de um doente com leucemia linfoblástica aguda (LLA), seta a apontar para um linfoblasto
b: linfoblasto: núcleo grande, citoplasma escasso
| Características | Leucemia linfoblástica aguda | Leucemia mielóide aguda |
|---|---|---|
| Achados laboratoriais | Anemia Anemia Anemia is a condition in which individuals have low Hb levels, which can arise from various causes. Anemia is accompanied by a reduced number of RBCs and may manifest with fatigue, shortness of breath, pallor, and weakness. Subtypes are classified by the size of RBCs, chronicity, and etiology. Anemia: Overview and Types; trombocitopenia; leucócitos – variável | |
| Esfregaço de sangue periférico ou exame da medula óssea (morfologia) | Linfoblastos:
|
Mieloblastos:
|
| Citoquímica |
|
|
| Imunofenotipagem |
|
CD13, CD33, CD117, HLA-DR |
A quimioterapia, que pode ter duração de 2 a 3 anos, é altamente eficaz em doentes jovens.
| Tratamento | Leucemia linfoblástica aguda | Leucemia mielóide aguda |
|---|---|---|
| Indução |
|
|
| Consolidação | Opções:
|
Quimioterapia adicional (citarabina) |
| Manutenção |
|
Quimioterapia não mielossupressora e/ou agente terapêutico direcionado |
| Tratamento adicional |
|
Leucemia promielocítica aguda:
|
| Transplante de células hematopoéticas | Para doentes com mau prognóstico | |
| Prognóstico |
|
|