A célula sofre uma variedade de alterações em resposta a lesões, que podem ou não levar à morte da célula. Os estímulos danosos desencadeiam um processo de adaptação celular, através do qual as células respondem às alterações nocivas no seu ambiente. Mecanismos de adaptação excessivamente complexos levam a lesão celular. Os estímulos ligeiros levam a lesões reversíveis. Se o estímulo for grave ou persistente, a lesão torna-se irreversível. Os principais alvos da lesão celular são as membranas celulares, as mitocôndrias, a maquinaria de síntese proteica e o DNA. As múltiplas alterações celulares resultantes dos danos conduzem à morte celular. Os 2 principais tipos de morte celular são a necrose e a apoptose. A necrose é uma morte celular descontrolada, caracterizada por alterações inflamatórias numa situação patológica. A apoptose é a morte celular programada, um mecanismo com efeitos tanto fisiológicos como patológicos.
Última atualização: Sep 26, 2024
Conteúdo
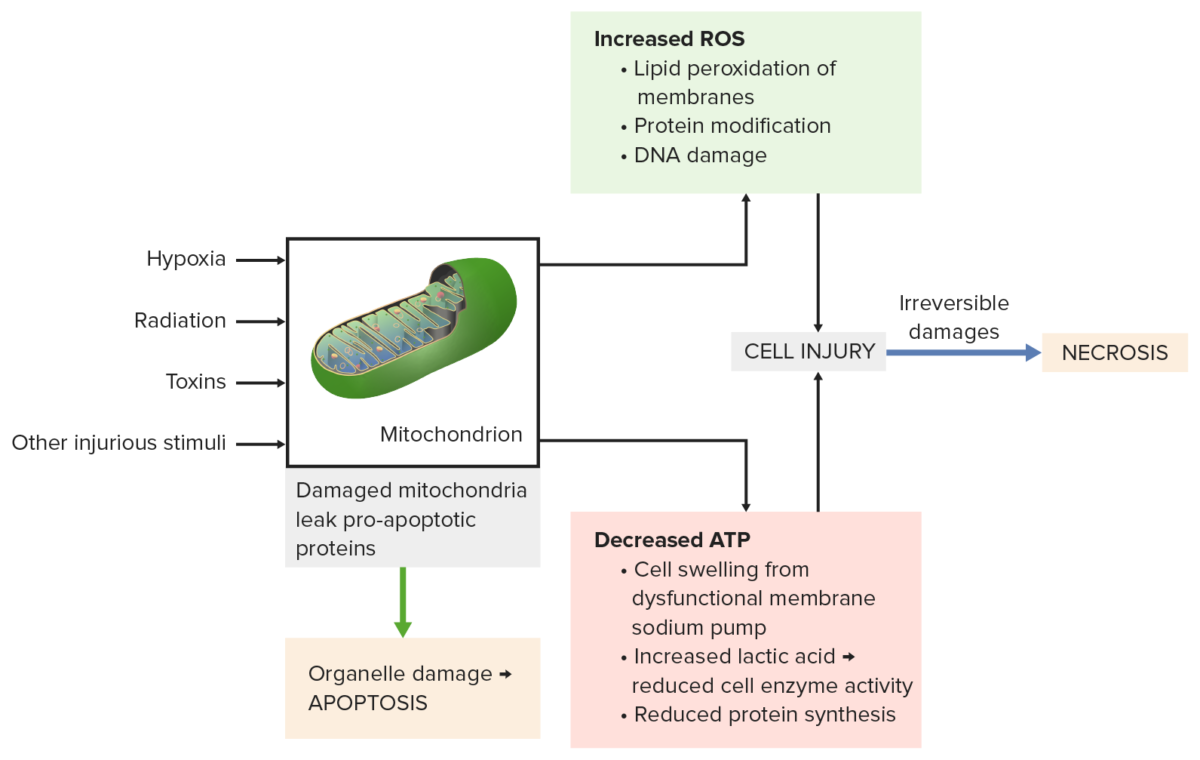
Os danos mitocondriais causados por estímulos nocivos (por exemplo, radiação, toxinas) levam a:
Em baixo à esquerda: Perda de proteínas pró-apoptóticas das mitocôndrias, causando apoptose.
Superior direito: Fosforilação oxidativa incompleta produz espécies reativas de oxigénio (ROS). As membranas, as proteínas e o DNA são danificados.
Em baixo à direita: A diminuição do ATP resulta em edema celular, redução da atividade enzimática e da síntese de proteínas.
Todos os processos levam a lesões celulares graves, depois ocorre necrose.
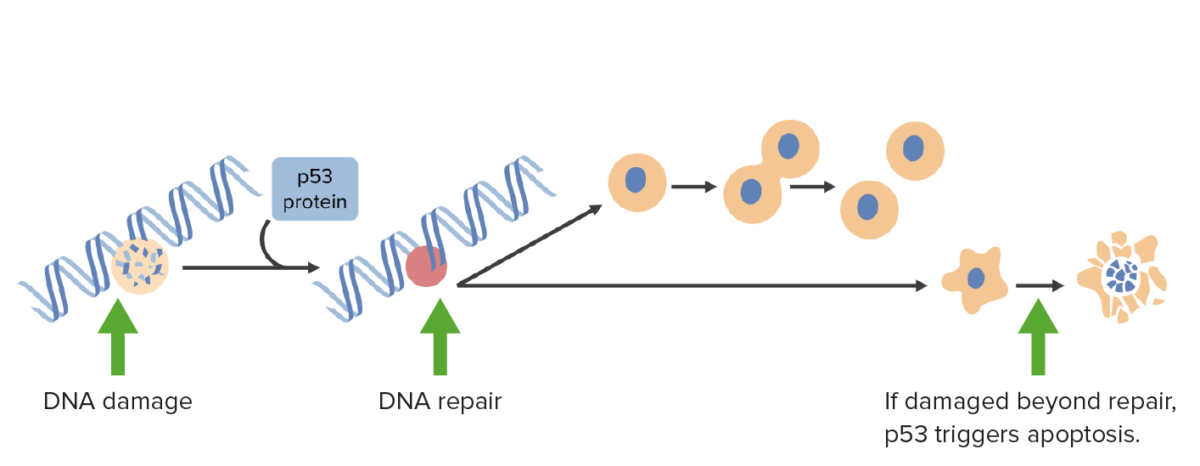
Os danos no DNA ativam a p53 que contém as células na fase G1 e desencadeia mecanismos de reparação do DNA. Se os danos forem irreparáveis, a p53 desencadeia a apoptose.
Imagem por Lecturio.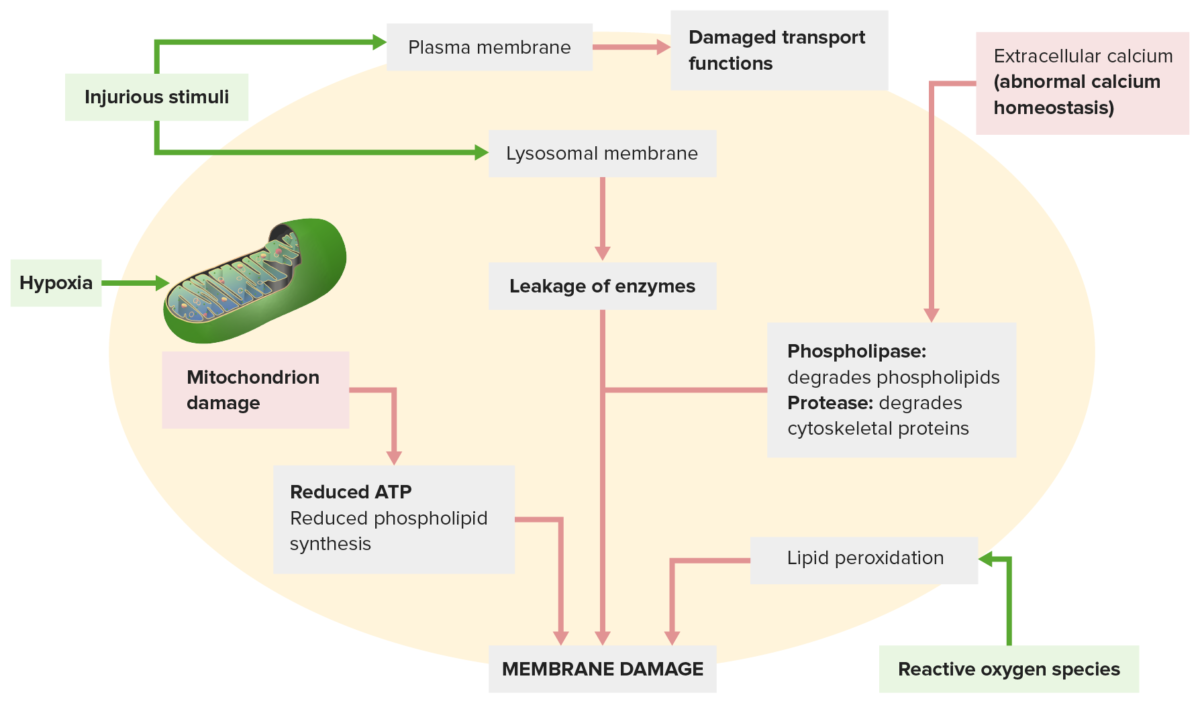
Os danos na membrana ocorrem a partir de:
Um estímulo prejudicial (em cima, à esquerda) leva à afeção das funções de transporte. O estímulo nocivo também afeta as membranas lisossómicas, com extravazamento de enzimas que danificam a célula.
Outros mecanismos: A homeostasia anormal do cálcio (em cima, à direita) liberta enzimas que degradam a membrana; a disfunção mitocondrial (em baixo, à esquerda) reduz a produção de ATP necessária para a síntese da membrana.
Espécies reativas de oxigénio (em baixo, à direita) causam peroxidação lipídica, levando à perda de fosfolípidos de membrana.
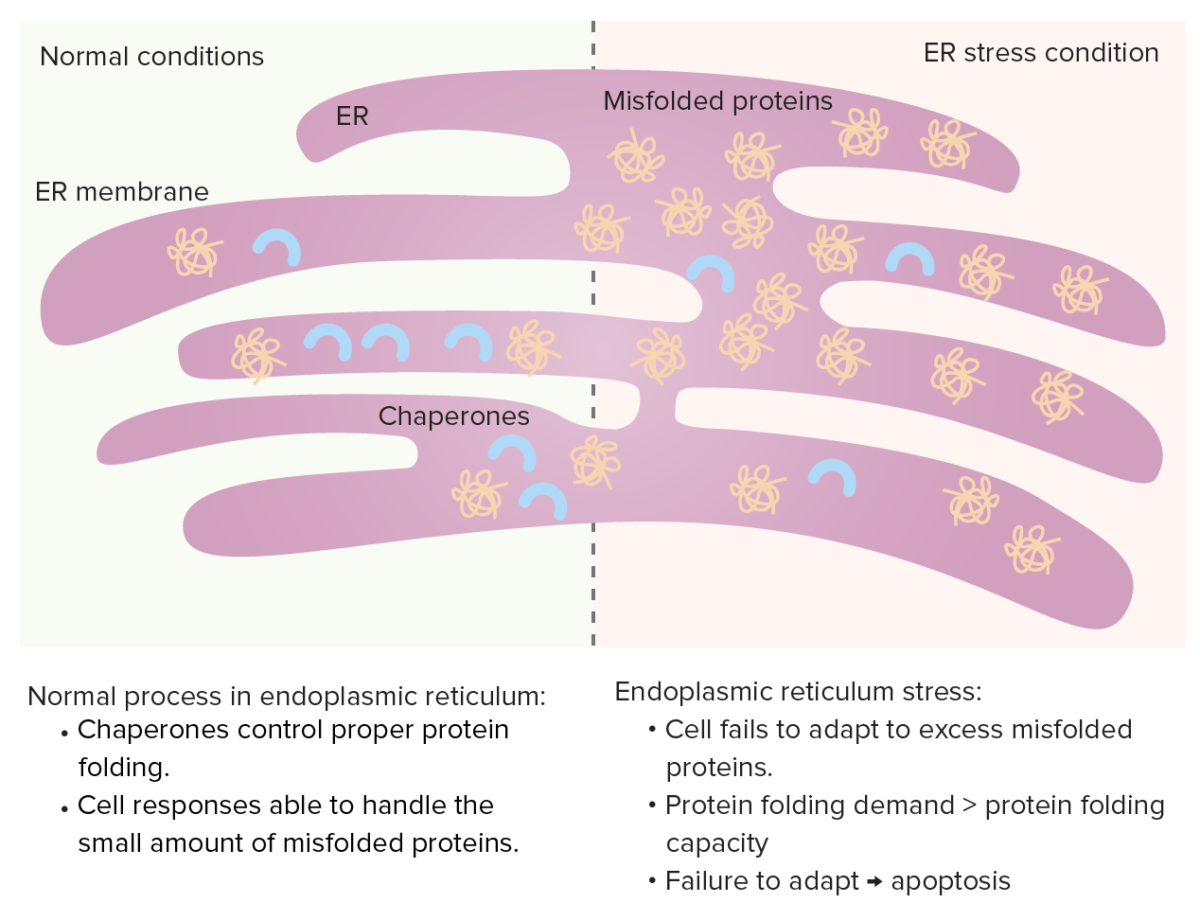
Retículo Endoplásmico (RE)
As chaperones controlam o enovelamento de proteínas no RE e as proteínas com enovelamento errado normalmente sofrem proteólise. Quando as proteínas com enovelamento errado aumentam, ocorre uma resposta das proteínas não enoveladas (aumento de chaperones, diminuição da síntese proteica e aumento da degradação das proteínas com enovelamento incorreto).
Stress no RE: Se a necessidade de enovelamento de proteínas aumenta (excesso de proteínas com enovelamento errado), essa capacidade fica saturada, levando à apoptose celular.
Caspases:
Via intrínseca (iniciação):
Via extrínseca (iniciação):
Fase de execução:
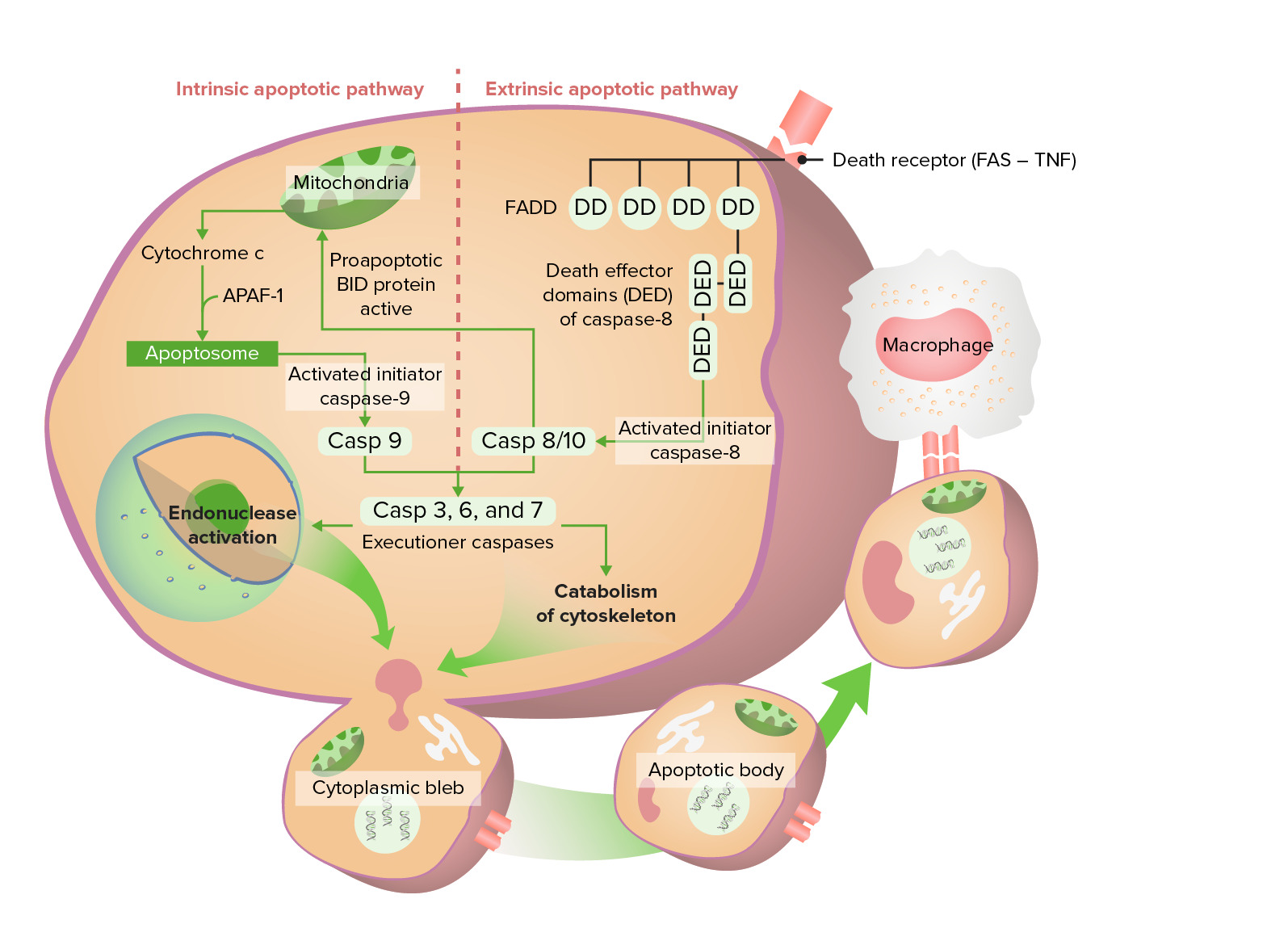
Vias apoptóticas intrínseca e extrínseca
A via intrínseca começa com a libertação do citocromo c, ativando eventualmente a caspase 9. A via extrínseca começa com a ativação do Fas (recetor de morte), que leva a uma caspase 8/10 ativa. Estas caspases passam pela fase de execução, formando finalmente corpos apoptóticos que sofrem fagocitose.
| Características da necrose | Características da apoptose | |
|---|---|---|
| Tamanho da célula | Aumentada (edema) | Reduzida (encolhimento) |
| Núcleo | Picnocitose, cariorrexis, cariólise | Fragmentação em fragmentos do tamanho de um nucleossoma |
| Membrana plasmática | Afetada (com disrupção) | Estrutura intacta mas alterada (orientação dos lípidos) |
| Conteúdo celular | Digestão enzimática; extravazamento para fora da célula | Intacto; libertado em corpos apoptóticos |
| Inflamação adjacente | Frequente | Não |
| Papel fisiológico ou patológico | Patológico (resultado de lesão celular irreversível) |
Fisiológico: eliminação de células indesejadas Patológico: lesão celular por danos no DNA e nas proteínas |
Necrose coagulativa:
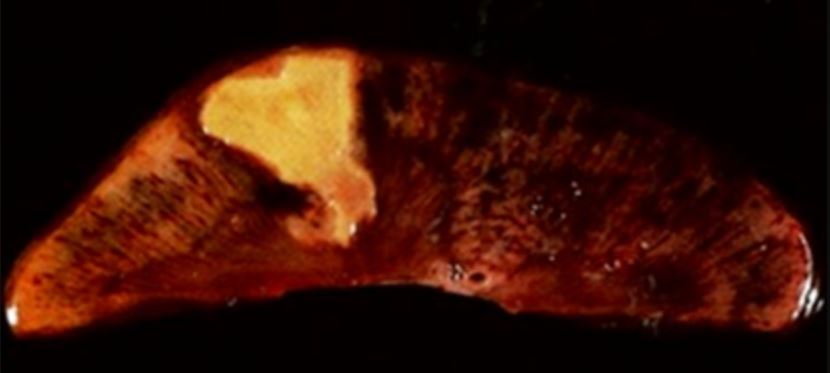
Necrose coagulativa no tecido renal
Imagem: “Coagulative necrosis in kidney tissue” por Dentl college survival kit. Licença: Public DomainNecrose de liquefação:
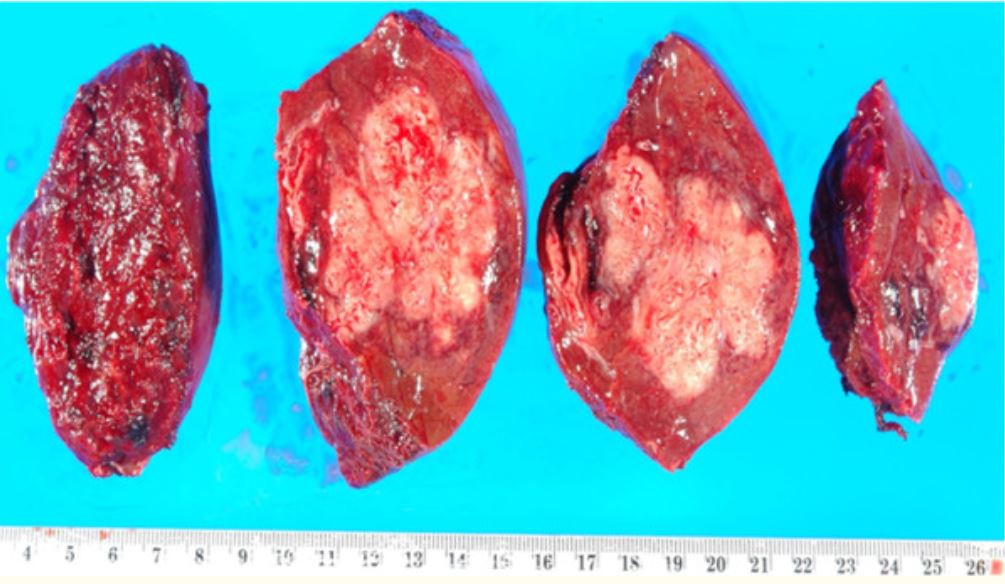
Porção ressecada do fígado com um abscesso, que é uma manifestação de necrose de liquefação
Imagem: “Resection of a methicillin-resistant Staphylococcus aureus liver abscess in a patient with Crohn’s disease under infliximab treatment” por Togashi J, Sugawara Y, Akamatsu N, Aoki T, Ijichi M, Tanabe M, Kusaka K, Shibazaki M, Tadami T, Sakou M, Takazoe M, Bandai Y, Kokudo N . Licença: CCBY 2.0Necrose caseosa:
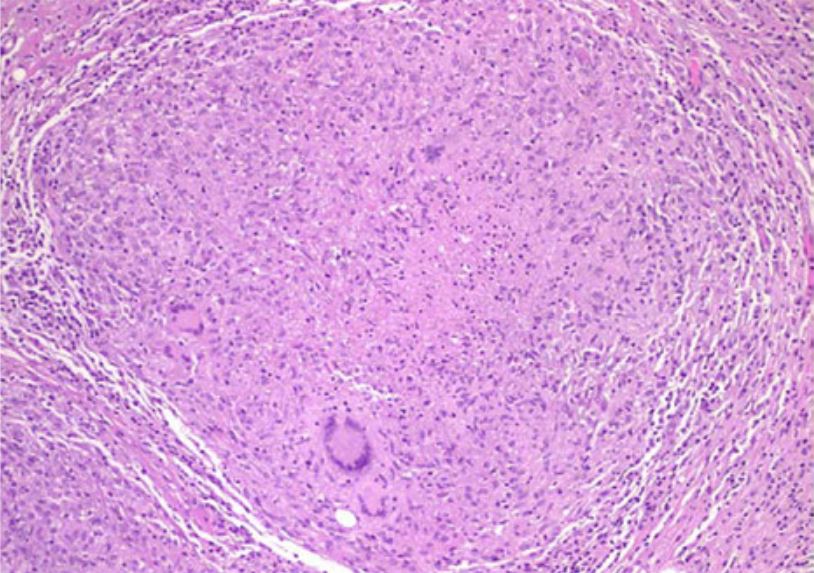
Exame histológico demonstrando um granuloma caseoso necrótico numa peritonite tuberculosa
Imagem: “Tuberculous peritonitis in pregnancy” por Lahbabi M, Brini J, Massaoudi K. License: CCBY 2.0Necrose gorda:
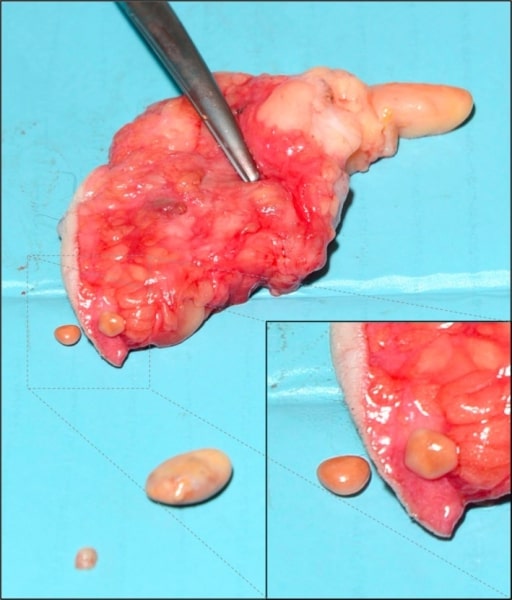
Necrose gorda subcutânea da mama: acredita-se ser devida a isquemia e necrose de tecido adiposo relacionada com traumatismo
Imagem: “Subcutaneous encapsulated fat necrosis” por Aydin D, Berg JO. Licença: CC BY 4.0Necrose fibrinoide:
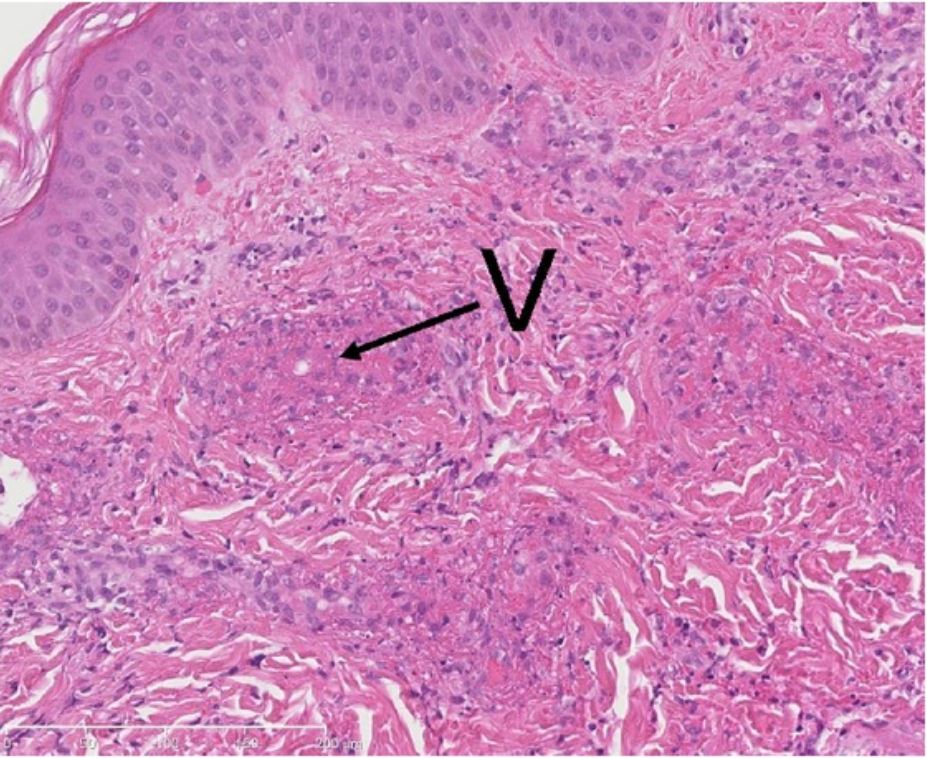
Biópsia de uma lesão cutânea (com vasculite leucoclástica): infiltrado neutrofílico e exsudado de fibrina (necrose fibrinoide) nas paredes dos pequenos vasos (V).
Imagem: “Methylprednisolone therapy in acute hemorrhagic edema of infancy” por Risikesan J, Koppelhus U, Steiniche T, Deleuran M, Herlin T. License: CC BY 3.0Necrose gangrenosa:
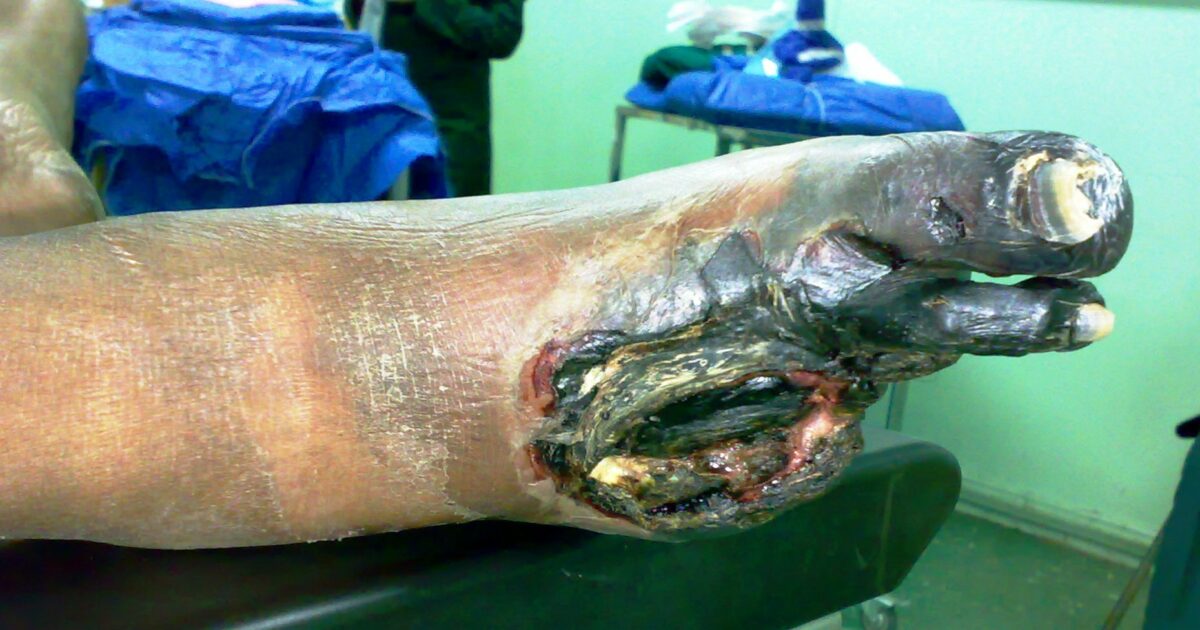
Imagem de um pé com gangrena: os dedos afetados foram perdidos devido à perda do suprimento de sangue.
Imagem: “Gangrene Foot” por آرمین. Licença: CC0 0.1Calcificação distrófica:
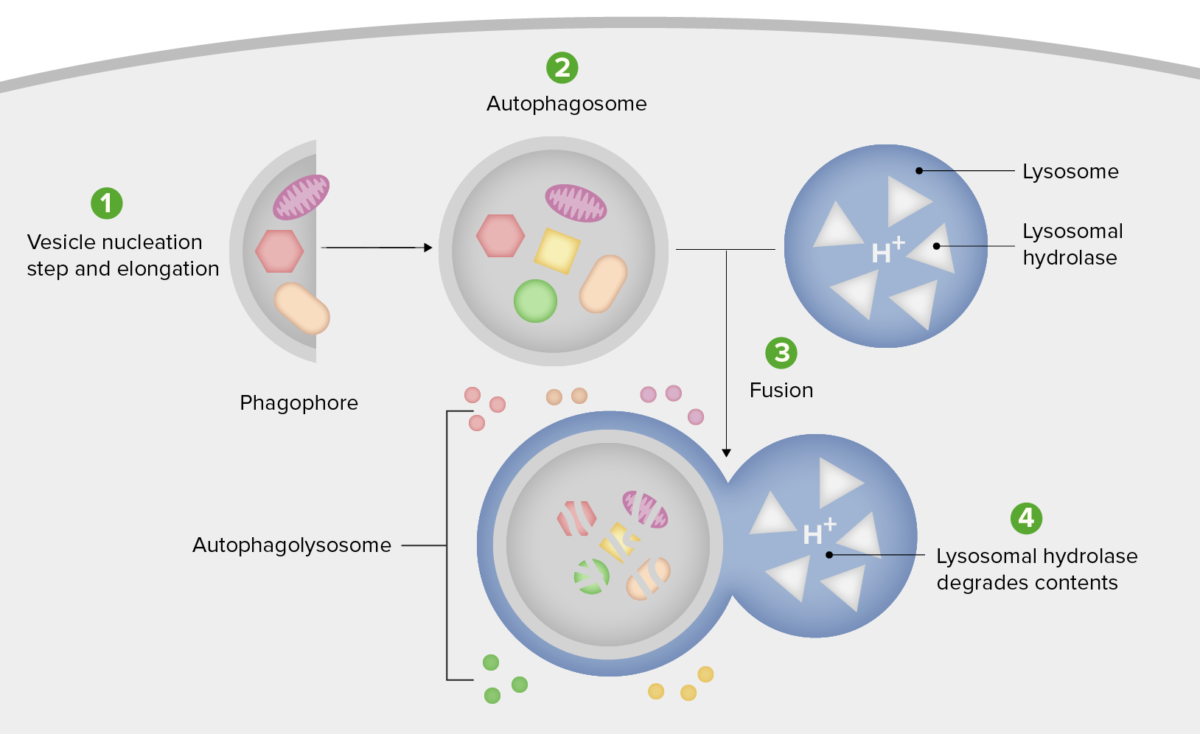
Diagrama esquemático dos passos da autofagia
1. Formação do fagóforo ou membrana de isolamento (nucleação da vesícula e etapa de alongamento).
2. Expansão do fagóforo para um autofagosoma.
3. Fusão do autofagosoma com um lisossoma formando um autofagolisossoma.
4. O material sequestrado é degradado no interior do autofagolisossoma e reciclado.