A lesão celular isquémica é a lesão de uma célula que resulta da redução do fluxo sanguíneo. O processo envolve hipoxia por interrupção do fornecimento de sangue, falta de nutrientes e acumulação de metabolitos tóxicos. Os danos celulares podem ser reversíveis (a função regressa quando o fluxo sanguíneo recomeça) ou irreversíveis (o limiar de reversibilidade já foi ultrapassado). Apesar de o fluxo sanguíneo poder ser restaurado e permitir a recuperação celular, é possível haver lesão de reperfusão em tecidos previamente isquémicos. Ao produzir sobrecarga de cálcio, stress oxidativo e mecanismos inflamatórios envolvendo células imunes, citocinas e o sistema de complemento, a reperfusão também pode levar à morte celular (muitas vezes por necrose). A suscetibilidade à isquemia é afetada por diferentes fatores, que incluem uma atividade metabólica elevada, a presença de circulação colateral, áreas com duplicação do suprimento sanguíneo e a magnitude da isquemia. O órgão mais MAIS Androgen Insensitivity Syndrome suscetível à isquemia é o cérebro. Outros órgãos suscetíveis incluem o coração, os rins, o fígado e o intestino grosso.
Last updated: Dec 15, 2025
A lesão celular isquémica é um dano resultante de uma diminuição do fluxo sanguíneo, que leva à hipoxia, à falta de nutrientes e à acumulação de metabolitos tóxicos.
Num contexto de lesão celular, ou as células não se conseguem adaptar ou excede-se a resposta adaptativa máxima a estímulos fisiológicos ou patológicos.
A isquemia e a lesão de reperfusão são duas causas de estímulos que levam à lesão e à morte celular.
Outros estímulos danosos incluem causas físicas como traumatismos ou radiação, produtos químicos, perda de nutrientes críticos e mutações.
Fases de lesão e morte celular:
Necrose (causa mais MAIS Androgen Insensitivity Syndrome comum):
Apoptose (pequena percentagem):
As células mortas são substituídas por fosfolípidos e mielina, resultando na clarificação ou fagocitose por macrófagos.
As lesões por isquemia podem dever-se a:
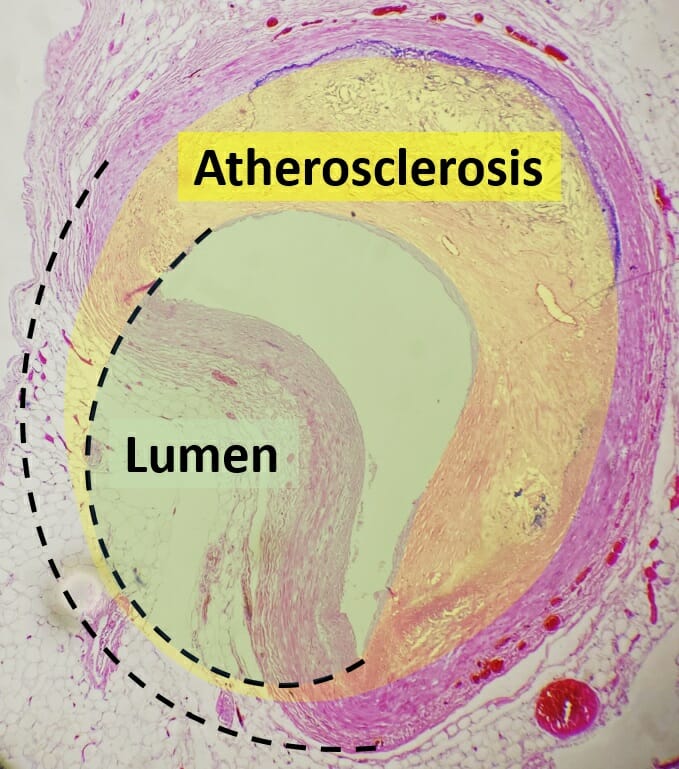
Histopatologia de uma artéria coronária colapsada devido a aterosclerose
Imagem: “Histopathology of coronary artery atherosclerosis, annotated” por Mikael Häggström. Licença: CC0 1.0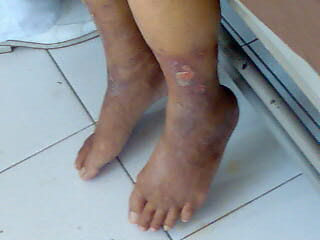
Úlceras nos membros provocadas por doença venosa periférica
Imagem: “Peripheral Vascular Disease” por Wfnicdao. Licença: Public DomainA perfusão é restaurada, o que traz vias prejudiciais:
A combinação dos mecanismos induz:
A arquitetura celular é perdida e segue-se a morte celular.
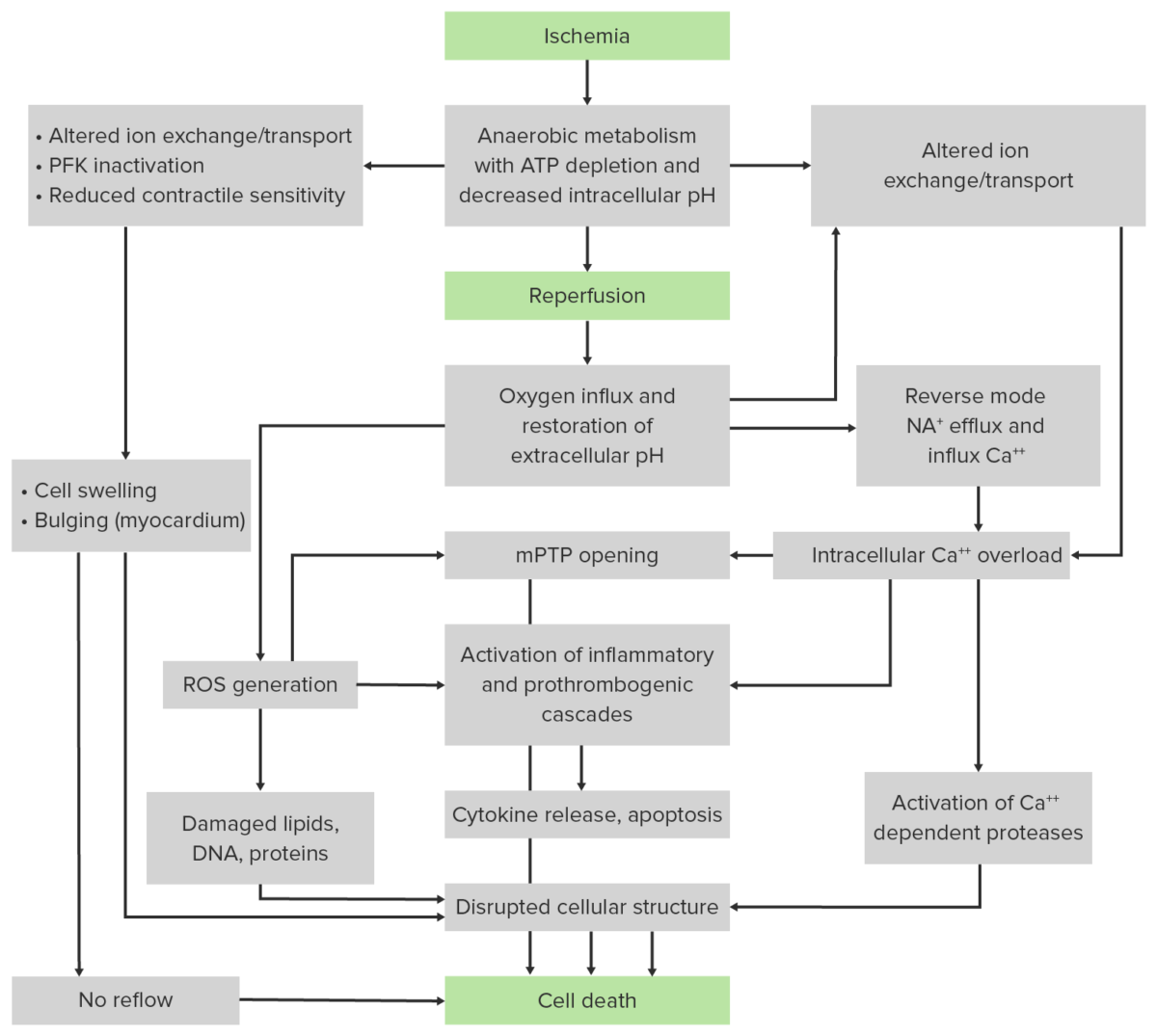
Fluxograma que resume os principais eventos patológicos que contribuem para os componentes de isquemia (painel superior) e de reperfusão (painel médio) da lesão tecidual:
Na isquemia prolongada, a hipoxia leva à depleção de ATP e à redução do pH intracelular (a partir da acumulação de lactato). Os mecanismos de transporte de iões dependentes de ATP tornam-se desorganizados, causando sobrecarga de cálcio celular, edema/ruptura, e morte.
Quando os níveis de oxigénio são restaurados (reperfusão), geram-se espécies reativas de oxigénio (ROS). Também ocorrem alterações pró-inflamatórias: Os neutrófilos infiltram-se nos tecidos isquémicos e agravam a lesão isquémica. Os eventos patológicos levam à abertura do poro de transição de permeabilidade mitocondrial (mPTP) na membrana mitocondrial interna, o que permite a passagem de moléculas para as mitocôndrias e afeta ainda mais a produção de ATP.
PFK: fosfofrutocinase
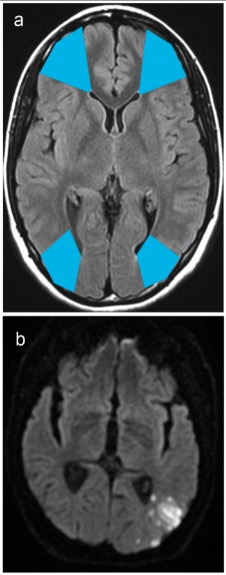
Áreas de suprimento duplo e enfartes vistos na RMN:
a: As áreas de suprimento duplo entre os territórios das artérias cerebrais anterior e média são vistas na região azul anterior.
As áreas de suprimento duplo entre os territórios das artérias média e posterior são vistas na região azul posterior.
b: O enfarte da região de suprimento duplo occipital é visto nos limites dos territórios das artérias média e posterior.
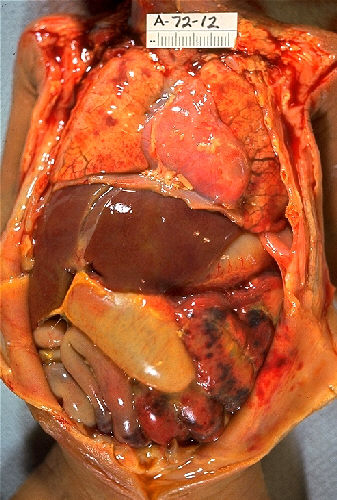
Enterocolite necrosante num bebé:
Repare nas áreas de necrose no intestino.
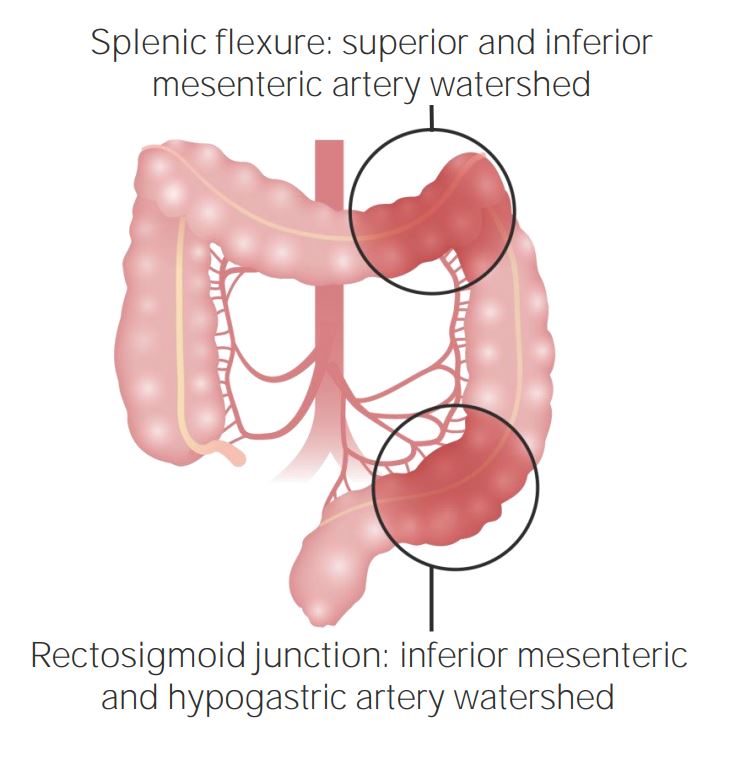
Áreas de suprimento duplo do cólon
Imagem por Lecturio.