Os inibidores do sistema renina-angiotensina-aldosterona constituem uma importante classe de fármacos para o tratamento de doenças cardiovasculares. São anti-hipertensivos de 1ª linha, além de serem utilizados no tratamento de EAM (enfarte agudo do miocárdio), insuficiência cardíaca, nefropatia diabética e acidente vascular cerebral. Os inibidores do sistema renina-angiotensina-aldosterona incluem IECAs (inibidores da enzima de conversão da angiotensina), ARAs (antagonistas dos recetores de aldosterona), iDRs (inibidores diretos da renina), IRANs (inibidores dos recetores da angiotensina e da neprilisina) e antagonistas da aldosterona, que afetam diferentes componentes da via do SRAA. Em geral, o uso de inibidores do SRAA resulta na diminuição da vasoconstrição e do volume sanguíneo sérico. Os efeitos adversos comuns incluem hipercalemia, tosse, angioedema e pancreatite, mais comuns com o uso de IECA do que com ARA.
Última atualização: Jul 11, 2023
Os inibidores do sistema renina-angiotensina-aldosterona constituem uma classe importante de fármacos para o tratamento de doenças cardiovasculares e são agentes de primeira linha para o tratamento da hipertensão.
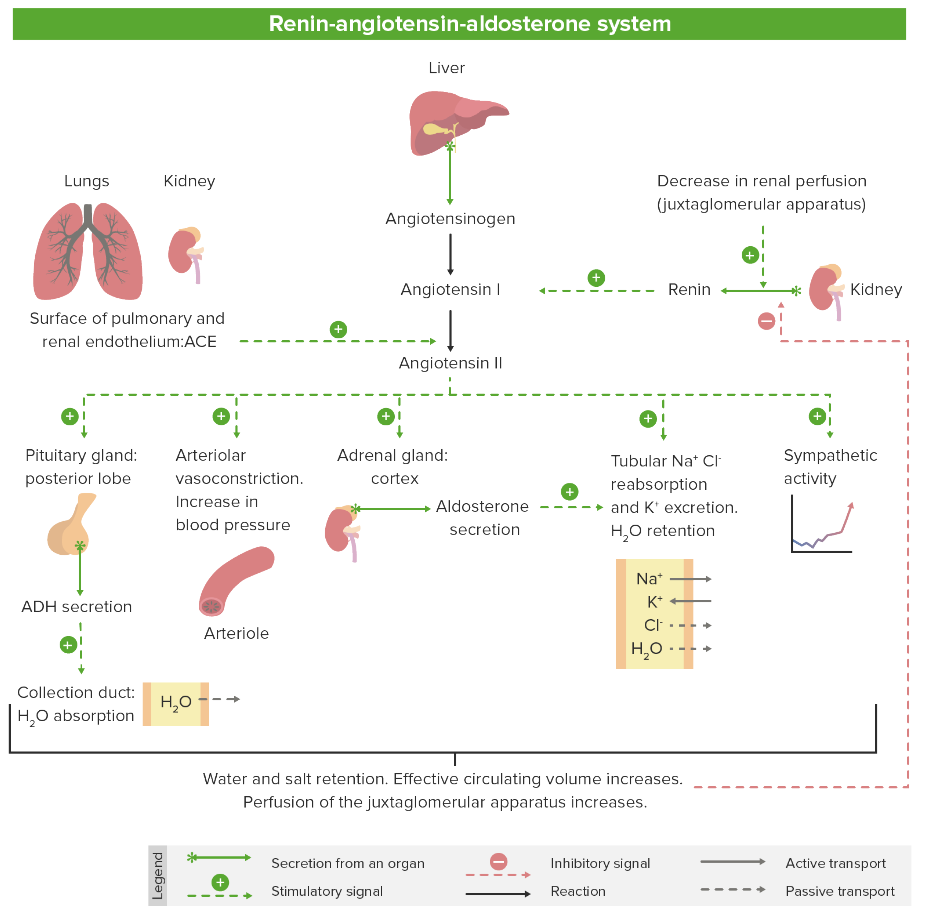
Descrição geral do SRAA
Imagem por Lecturio. Licença: CC BY-NC-SA 4.0Os medicamentos da classe dos inibidores SRAA incluem:
| Local de ação | Classe | Subclasse |
|---|---|---|
| Renal | Fármacos que afetam o SRAA |
|
| Diuréticos |
|
|
| Extrarrenal | Vasodilatadores diretos |
|
| Agentes que atuam via sistema nervoso simpático |
|
Todos os fármacos dentro de uma classe têm a mesma estrutura básica, mas diferentes grupos funcionais anexados, o que explica os seus diferentes perfis farmacocinéticos e de segurança.
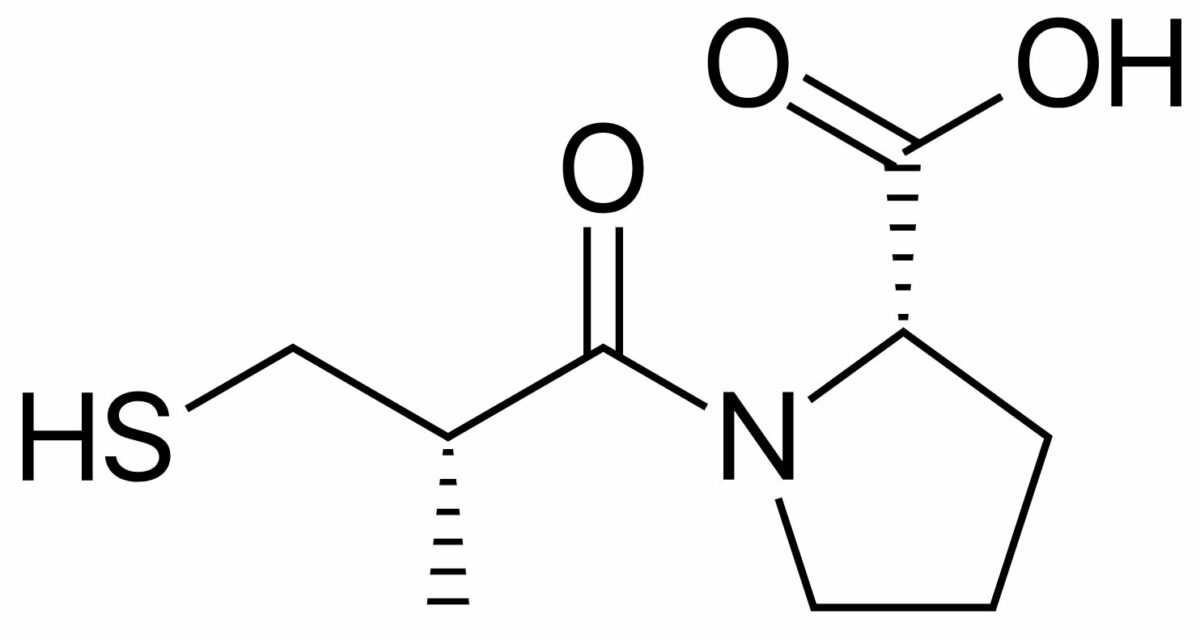
Estrutura química do captopril (nome comercial Capoten), um IECA amplamente utilizado
Imagem: “Captopril structure” por Vaccinationist. Licença: Public Domain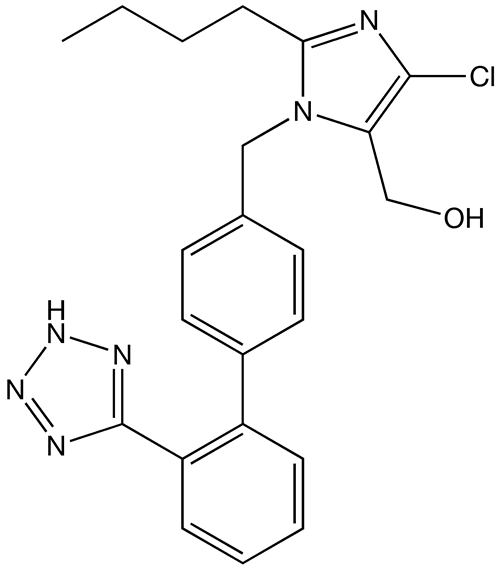
Estrutura química do losartan, um ARA amplamente utilizado
Imagem: “Losartan structure” por Techelf. Licença: Public Domain| Classe do fármaco | Mecanismo de ação | Efeitos fisiológicos |
|---|---|---|
| IECAs | Inibe a ECA, evitando:
|
Resistência vascular periférica diminuída através de:
|
| ARAs | Inibe os recetores da angiotensina-1, impedindo-os de exercer os seus efeitos |
|
| iDRs | Inibe diretamente a atividade da renina, bloqueando a conversão do angiotensinogénio em angiotensina I | ↓ Angiotensina I, angiotensina II e aldosterona → ↓ resistência vascular periférica |
| IRANs | Combinação de ARA e um inibidor de neprilisina:
|
|
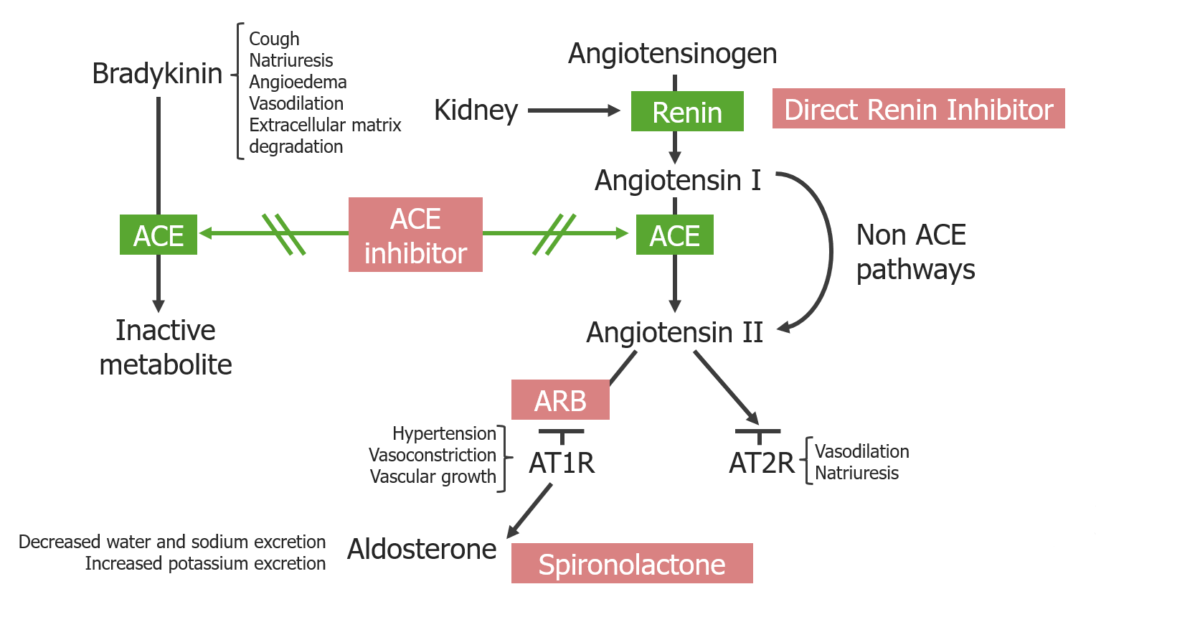
Descrição geral dos inibidores SRAA e a sua localização de ação:
Os inibidores da ECA bloqueiam a degradação da bradicinina e a formação de angiotensina II.
Os ARAs bloqueiam os recetores de angiotensina II tipo 1. Os inibidores diretos da renina bloqueiam a formação da angiotensina I.
A espironolactona bloqueia os recetores mineralocorticóides nas células principais dos túbulos renais distais e do ducto coletor cortical.
| Fármaco | Absorção | Distribuição | Metabolismo | Excreção |
|---|---|---|---|---|
| IECAs |
|
A maioria dos fármacos tem ligação mínima às proteínas e volumes relativamente modestos de distribuição | Os pró-fármacos são ativados por hidrólise no fígado; fármacos ativos permanecem inalterados. |
|
| ARAs |
|
|
Metabolismo hepático |
|
| iDR: aliscireno |
|
Ligação às proteínas: 50% | Desconhece-se a extensão do metabolismo hepático |
|
Os efeitos adversos mais comuns dos IECA e ARAs estão apresentados na tabela.
| Sintoma | IECAs | ARAs (e IRANs) |
|---|---|---|
| Hipercalemia | 1% | 0.3% |
| Tosse | 10 %‒20% | 1 em 1.000 |
| Pancreatite | 1 em 5.000 |
|
| Angioedema | 1 em 2.000 | 1 em 20.000 |
Os efeitos adversos adicionais podem incluir:
| Fármacos | Mecanismos | Efeitos fisiológicos | Indicações |
|---|---|---|---|
| IECAs | Inibir ACE, que:
|
|
|
| ARAs | Inibe os recetores da angiotensina-1, impedindo-os de exercer os seus efeitos |
|
|
| Bloqueadores dos canais de cálcio | Liga e inibe os canais de cálcio tipo L nos miócitos cardíacos e músculo liso vascular |
|
|
| Beta bloqueantes | Inibe os recetores de catecolaminas β com afinidade variável para os recetores β 1 vs β 2 |
|
|
| Diuréticos tiazídicos | ↓ Reabsorção de NaCl no túbulo contornado distal pela inibição do cotransportador Na + / cloreto |
|
|
| Diuréticos de ansa | Inibe o co-transportador luminal Na + / K + / cloreto no ramo ascendente espesso da ansa de Henle |
|
|
| Diuréticos poupadores de K + |
|
|
|