A hemoglobinúria paroxística noturna (HPN) é uma anemia hemolítica adquirida rara, mas grave, com períodos de exacerbação. Esta anemia é causada pela expansão clonal não maligna de ≥ 1 células-estaminais hematopoiéticas que adquiriram uma mutação somática do gene da subunidade A da fosfatidilinositol N -acetilglucosaminiltransferase (PIG-A). A expansão clonal destas células é deficiente em proteínas ancoradas por glicosilfosfatidilinositol (GPI-APs). A deficiência dos GPI-APs CD55 e CD59, que regulam o complemento, resulta em hemólise intravascular. A tríade clássica da HPN é definida por anemia hemolítica, insuficiência medular e trombofilia. Os pacientes podem ser tratados com o anticorpo monoclonal eculizumab ou com transplante de células-estaminais, além de geridas as complicações associadas.
Última atualização: Jun 14, 2022
Hemoglobinúria paroxística noturna clássica (HPN):
HPN no contexto de um distúrbio específico da medula óssea:
HPN subclínica (HPN-sc):
Gene PIG-A (fisiologia normal) :
Gene PIG-A (mutação) :
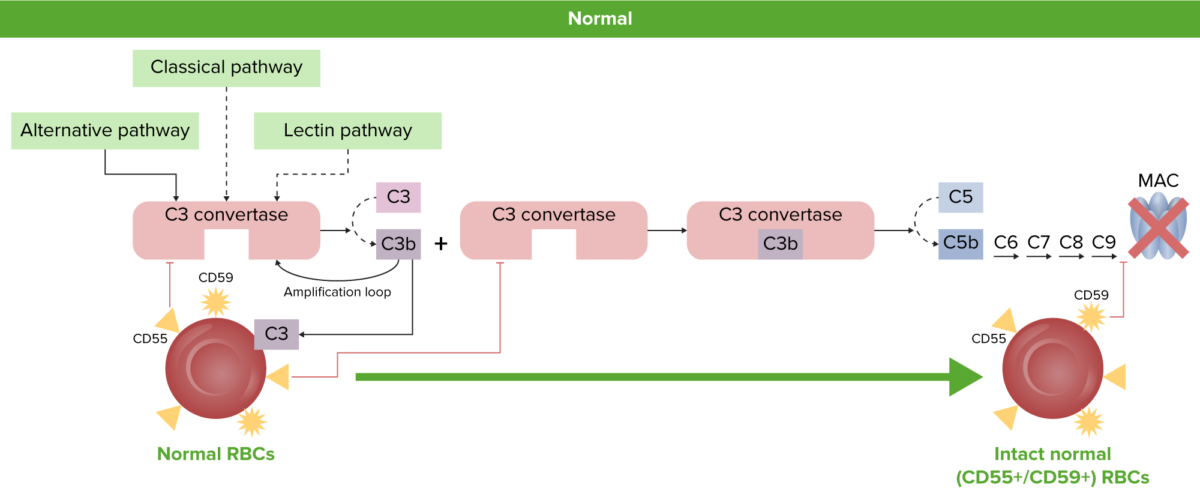
Fisiologia do GV normal:
Os GV normais são protegidas da ativação do complemento e hemólise pelas proteínas reguladoras do complemento ligadas a GPI, CD55 e CD59.
GPI: glicosilfosfatidilinositol
CAM: complexo de ataque à membrana
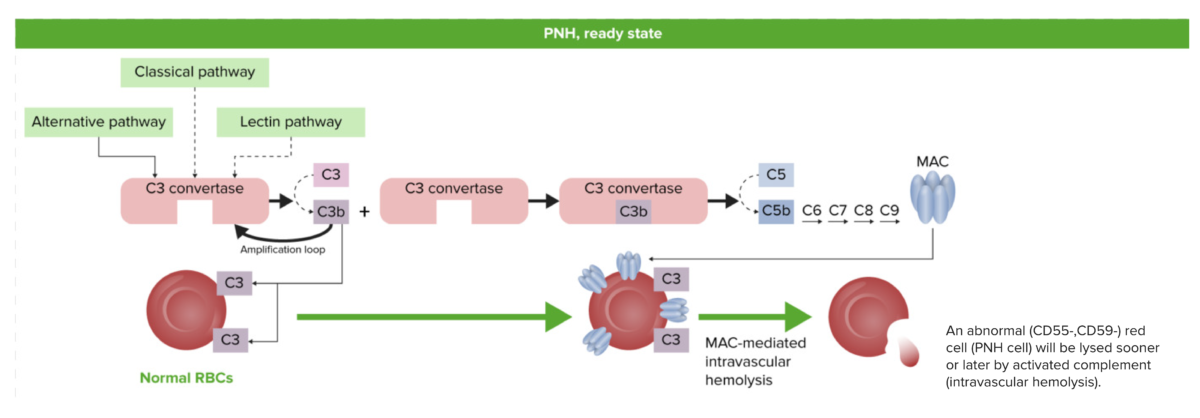
Fisiologia da hemoglobinúria paroxística noturna (HPN) no estado estacionário:
Mesmo na ausência de inflamação, infeção ou outro trigger, os eritrócitos com GPI reduzido ou nenhum na sua superfície são suscetíveis ao ataque do complemento pela ativação espontânea do complemento a partir de uma quantidade mínima, mas constante de C3 ativado (o “tickover C3”). A hemólise intravascular ocorre devido à formação de um complexo de ataque à membrana (CAM), que causa distorção focal e buracos na membrana celular. Se o complemento extra for ativado pela via clássica antígeno-anticorpo (por exemplo, por infeção), então a hemólise será aumentada; isto corresponde à exacerbação paroxística da doença.
GPI: glicosilfosfatidilinositol

Amostra de urina de um paciente com HPN (esquerda) e de um controlo saudável (direita).
A urina do paciente está vermelha devido à hemólise intravascular com hemoglobinúria. A hemólise ocorre ao longo do dia, não apenas à noite.
Os neutrófilos também apresentam deficiência de GPI-APs:
Os fatores mediados por plaquetas incluem:
A trombose em locais incomuns (veias hepáticas, mesentéricas, cerebrais, dérmicas) é típica da HPN.
A insuficiência renal é progressiva e multifatorial.
As exacerbações da hemólise podem ser devidas a:
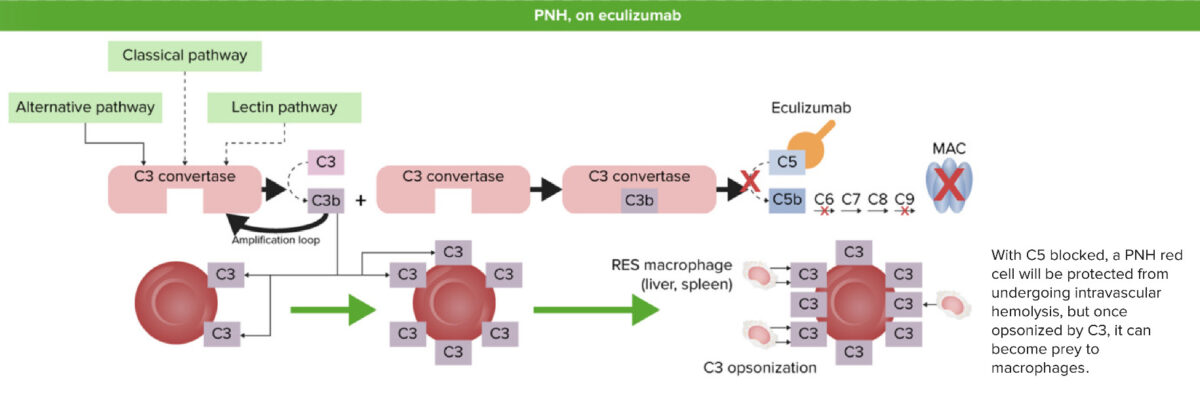
Hemoglobinúria paroxística noturna após eculizumab:
Quando C5 é bloqueado (inibido) pelo eculizumab, a C5 convertase não pode formar C5b a partir da clivagem de C5. O complexo de ataque à membrana (CAM) não é formado e não ocorre hemólise intravascular. No entanto, os fragmentos C3 que foram libertados no início do processo de ativação irão revestir as hemácias desprotegidas e causar hemólise extravascular pelo sistema reticuloendotelial (SRE) no fígado e no baço.
Esses sintomas são devidos à diminuição do ON circulante: