A esferocitose hereditária (EH) é o tipo mais comum de anemia hemolítica hereditária. Esta condição é causada por uma deficiência de uma proteína do citoesqueleto na membrana dos glóbulos vermelhos (GV). Isso resulta na perda de estabilidade e deformabilidade da membrana dos GV, dando à célula uma forma esférica (esferócito). Essas células estão predispostas à degradação esplênica, levando à hemólise. O exame físico pode mostrar icterícia e esplenomegalia, enquanto os exames laboratoriais são consistentes com anemia hemolítica e aumento da concentração de hemoglobina. Entre os múltiplos testes confirmatórios para EH, o teste de ligação da eosina-5'-maleimida (EMA) é o preferido. O único tratamento definitivo para EH é a esplenectomia.
Última atualização: Jan 17, 2025
Na EH, as mutações genéticas levam à deficiência da proteína do citoesqueleto :
Quatro categorias de apresentações clínicas foram estabelecidas com base na hemoglobina (Hb), contagem de reticulócitos (retic) e nível de bilirrubina (bili).
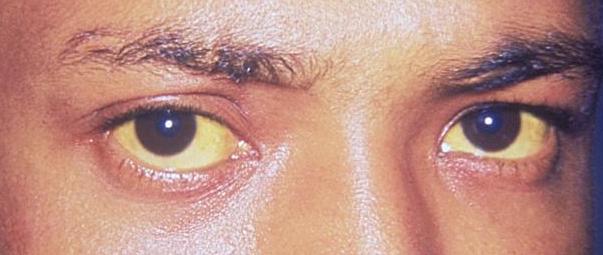
Icterícia das escleróticas: o primeiro sinal clínico de deposição de bilirrubina no organismo
Imagem: “Jaundice eye new” de CDC / Dr. Thomas F. Sellers / Emory University. Licença: Domínio Público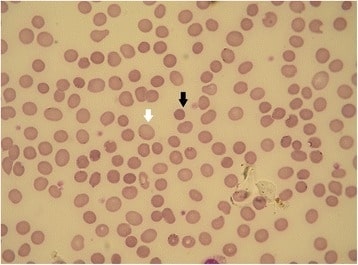
Esferocitose hereditária (EH): esfregaço de sangue periférico
A seta preta mostra um esferócito. A seta branca mostra um GV normal (a falta de palidez central é um artefato). As formas de esferocitose hereditária com diferentes defeitos de membrana podem apresentar diferentes morfologias de GV.
O diagnóstico diferencial inclui outras causas de hemólise, a maioria das quais mostrará pelo menos alguns esferócitos no sangue periférico.