Os linfócitos B, também conhecidos como células B, são componentes importantes do sistema imunológico adaptativo. Na medula óssea, as células-tronco hematopoiéticas passam por uma série de etapas para se tornarem células B naive maduras. As células migram para órgãos linfoides secundários para a sua ativação e posterior maturação. O processo envolve a estimulação do antigénio, com ou sem a ajuda de células T. A ativação independente de células T gera uma resposta imune de curta duração (via células plasmáticas), observada com antigénios como lipopolissacarídeos bacterianos. Por outro lado, a ativação dependente de células T produz células plasmáticas e células de memória. As células B ativadas proliferam então nos centros germinativos, mas nem todas se tornam células B efetoras. Através da hipermutação somática, as células B sofrem mecanismos adicionais para aumentar a afinidade do anticorpo pelo antigénio. Somente aquelas com recetores de células B de alta afinidade avançam posteriormente para a diferenciação terminal. As células B passam então por uma mudança de classe (de IgM IgM A class of immunoglobulin bearing mu chains (immunoglobulin mu-chains). Igm can fix complement. The name comes from its high molecular weight and originally being called a macroglobulin. Immunoglobulins: Types and Functions para outra classe de Ig Ig X-linked Agammaglobulinemia) sob a influência de citocinas. Após a troca de classe, as células B tornam-se células plasmáticas (que produzem anticorpos) ou células de memória (que desencadeiam uma resposta imune secundária robusta).
Last updated: Dec 15, 2025
Os linfócitos B (derivados da medula óssea), ou células B, são um tipo de linfócitos provenientes do progenitor linfoide comum.
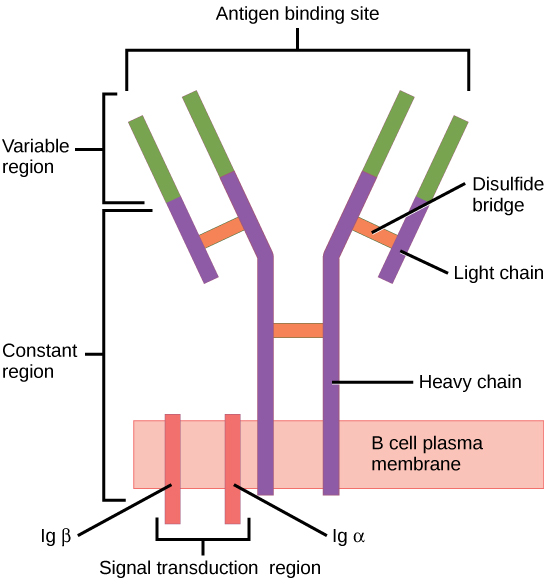
O recetor de células B (BCR, pela sigla em inglês) consiste na molécula de Ig e na molécula de sinalização:
A Ig contém 2 cadeias pesadas idênticas e 2 cadeias leves idênticas ligadas por uma ponte dissulfeto. A Ig ligada à membrana é ancorada à superfície da célula.
Para obter a sua funcionalidade, a célula B passa por etapas na medula óssea e nos órgãos linfoides secundários:
| Estadio de maturação | Genes Genes A category of nucleic acid sequences that function as units of heredity and which code for the basic instructions for the development, reproduction, and maintenance of organisms. DNA Types and Structure Ig Ig X-linked Agammaglobulinemia | Recetor de células B ( BCR BCR Lymphocytes: Histology) | Eventos associados |
|---|---|---|---|
| Independente de antigénio | |||
| Célula pré-pro-B | DNA DNA A deoxyribonucleotide polymer that is the primary genetic material of all cells. Eukaryotic and prokaryotic organisms normally contain DNA in a double-stranded state, yet several important biological processes transiently involve single-stranded regions. DNA, which consists of a polysugar-phosphate backbone possessing projections of purines (adenine and guanine) and pyrimidines (thymine and cytosine), forms a double helix that is held together by hydrogen bonds between these purines and pyrimidines (adenine to thymine and guanine to cytosine). DNA Types and Structure de linha germinativa | Nenhum | Sem expressão de cadeia pesada ou leve |
| Célula Pró-B | Rearranjo DJ IGH | Nenhum | Começa a expressar CD19, CD34 e HLA-DR (antigénio de histocompatibilidade de classe II) |
| Célula pré-B | Rearranjo IGH VDJ | Forma-se o Pré-BCR:
|
Surgem outros marcadores (CD79, CD10, CD20, CD40 CD40 Members of the tumor necrosis factor receptor superfamily with specificity for CD40 ligand. They are found on mature B-lymphocytes, some epithelial cells; and lymphoid dendritic cells. Evidence suggests that CD40-dependent activation of B-cells is important for generation of memory B-cells within the germinal centers. Mutations in the CD40 antigen gene result in hyper-igm immunodeficiency syndrome, type 3. Signaling of the receptor occurs through its association with tnf receptor-associated factors. Hyper-IgM Syndrome e desoxinucleotidil transferase terminal entre eles). |
| Célula B imatura |
|
BCR BCR Lymphocytes: Histology maduro (molécula IgM IgM A class of immunoglobulin bearing mu chains (immunoglobulin mu-chains). Igm can fix complement. The name comes from its high molecular weight and originally being called a macroglobulin. Immunoglobulins: Types and Functions) | A expressão de HLA-DR, CD19, CD20 e CD40 CD40 Members of the tumor necrosis factor receptor superfamily with specificity for CD40 ligand. They are found on mature B-lymphocytes, some epithelial cells; and lymphoid dendritic cells. Evidence suggests that CD40-dependent activation of B-cells is important for generation of memory B-cells within the germinal centers. Mutations in the CD40 antigen gene result in hyper-igm immunodeficiency syndrome, type 3. Signaling of the receptor occurs through its association with tnf receptor-associated factors. Hyper-IgM Syndrome continua, ao contrário de outros marcadores (por exemplo, CD10, CD34 e desoxinucleotidil transferase terminal). |
| Célula B madura (naive) |
|
Com BCR BCR Lymphocytes: Histology maduro ( IgM IgM A class of immunoglobulin bearing mu chains (immunoglobulin mu-chains). Igm can fix complement. The name comes from its high molecular weight and originally being called a macroglobulin. Immunoglobulins: Types and Functions) → saída da medula óssea | Expressam todos CD19 e CD20. |
| Dependente de antigénio | |||
| Célula B madura (em tecidos linfoides secundários) | BCR BCR Lymphocytes: Histology maduro (expressa IgM IgM A class of immunoglobulin bearing mu chains (immunoglobulin mu-chains). Igm can fix complement. The name comes from its high molecular weight and originally being called a macroglobulin. Immunoglobulins: Types and Functions e IgD IgD An immunoglobulin which accounts for less than 1% of plasma immunoglobulin. It is found on the membrane of many circulating B lymphocytes. Immunoglobulins: Types and Functions quando nos tecidos linfoides secundários) | As células podem descansar ou pode ocorrer a sua ativação: as células B interagem com o antigénio exógeno e/ou células T auxiliares. | |
| Célula B ativada | Troca de classe | Uma vez ativada, pode mudar para IgE IgE An immunoglobulin associated with mast cells. Overexpression has been associated with allergic hypersensitivity. Immunoglobulins: Types and Functions, IgG IgG The major immunoglobulin isotype class in normal human serum. There are several isotype subclasses of igg, for example, igg1, igg2a, and igg2b. Hypersensitivity Pneumonitis, IgA IgA Represents 15-20% of the human serum immunoglobulins, mostly as the 4-chain polymer in humans or dimer in other mammals. Secretory iga is the main immunoglobulin in secretions. Immunoglobulins: Types and Functions ou permanecer como IgM IgM A class of immunoglobulin bearing mu chains (immunoglobulin mu-chains). Igm can fix complement. The name comes from its high molecular weight and originally being called a macroglobulin. Immunoglobulins: Types and Functions | |
| Célula B de memória |
|
||
| Célula de plasma Plasma The residual portion of blood that is left after removal of blood cells by centrifugation without prior blood coagulation. Transfusion Products |
|
||
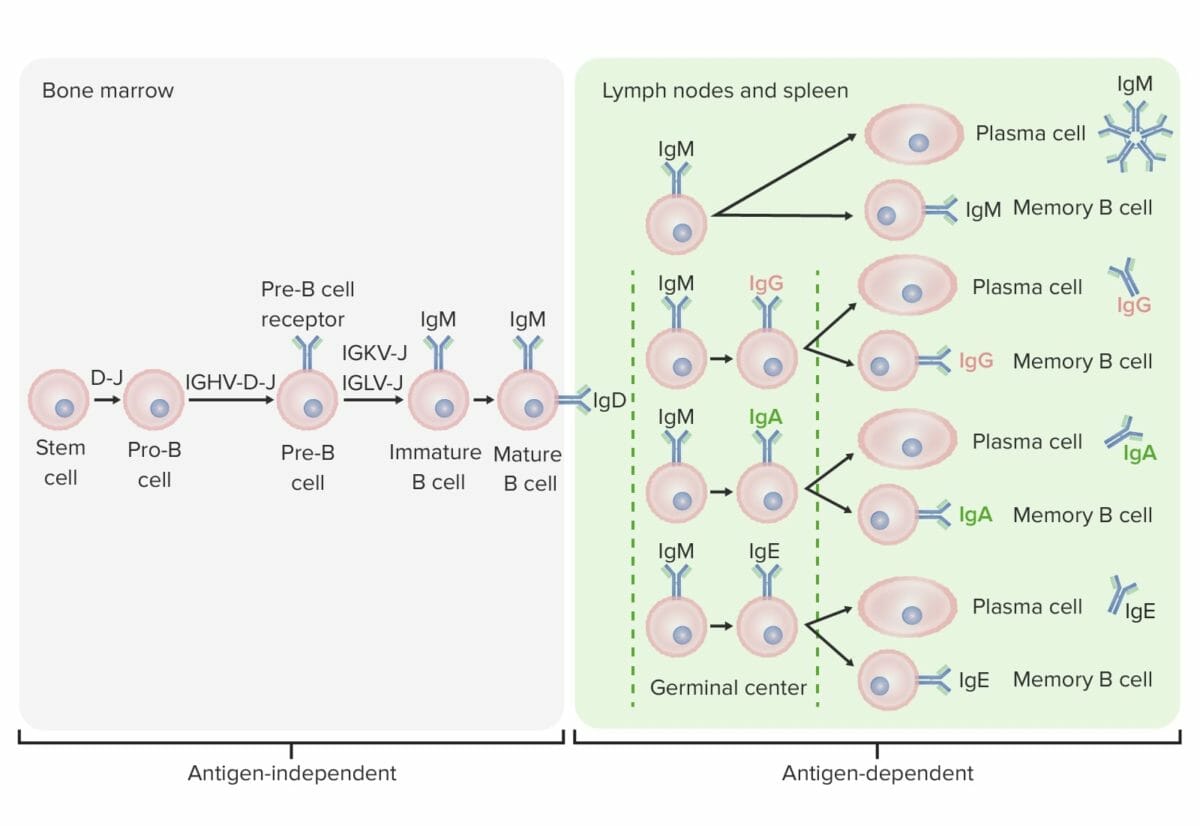
Fases de diferenciação da célula B:
Nos estadios independentes de antigénio, a produção de células B começa com a célula-tronco hematopoiética (HSC, pela sigla em inglês), que se torna um progenitor linfoide comum (CLP, pela sigla em inglês) e, de seguida, numa célula pré-pro-B ou célula progenitora B. Os próximos passos incluem o rearranjo de segmentos de genes para formar a molécula de Ig. As cadeias pesadas de imunoglobulinas começam com o rearranjo da diversidade e a junção de segmentos para formar a célula pró-B. Na etapa seguinte (célula pré-B), a recombinação da cadeia pesada de Ig (variabilidade, diversidade, junção) é completada e o recetor da célula pré-B é formado. O rearranjo da cadeia leve (kappa (κ) ou lambda (λ)) resulta na expressão de uma molécula de anticorpo IgM completa por uma célula B imatura. Segue-se a formação da célula B madura (“naive”) com IgM e IgD.
Os estadios dependentes de antigénio ocorrem em tecidos linfoides secundários. Uma vez que a célula B madura produz IgM e IgD, pode ocorrer uma mudança de classe para produzir IgE, IgG e IgA. As células B são ativadas e tornam-se células plasmáticas ou células de memória.
A célula B migra da medula óssea para os órgãos linfoides secundários. Este processo leva uma série de etapas para a produção de uma célula B diferenciada funcional: ativação por um antigénio, proliferação, maturação de afinidade, mudança de classe e diferenciação (em célula plasmática ou de memória).
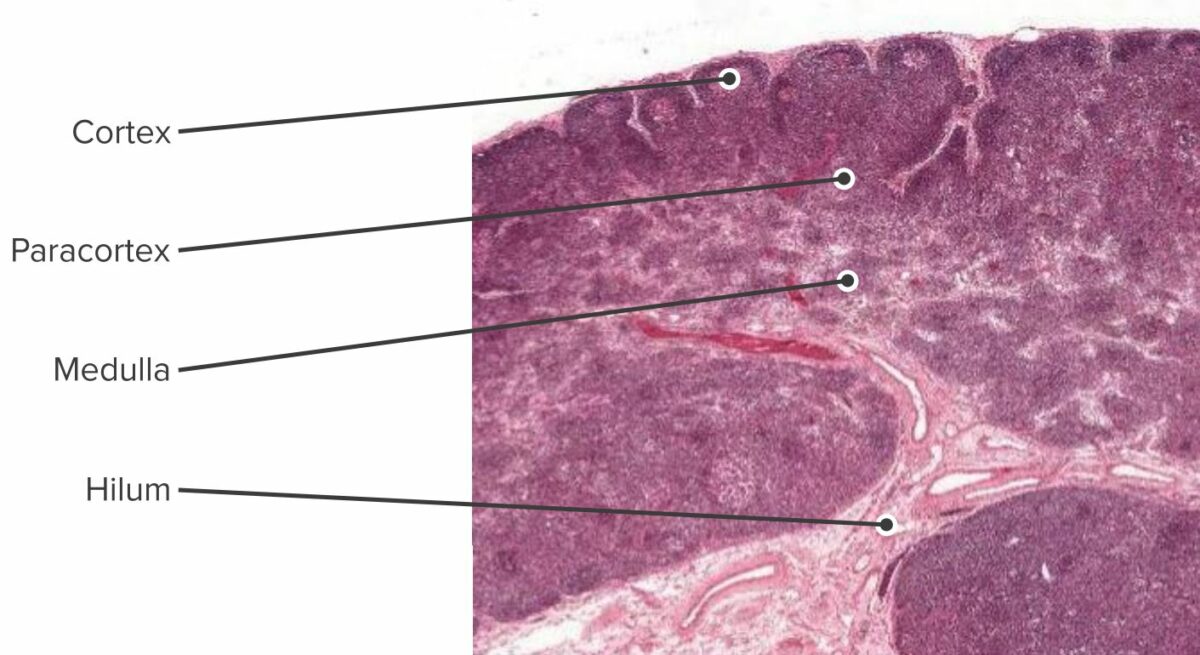
Corte histológico de um nódulo linfático, visualizando-se o córtex, o paracórtex e a medula
Imagem de Geoffrey Meyer, editada por Lecturio.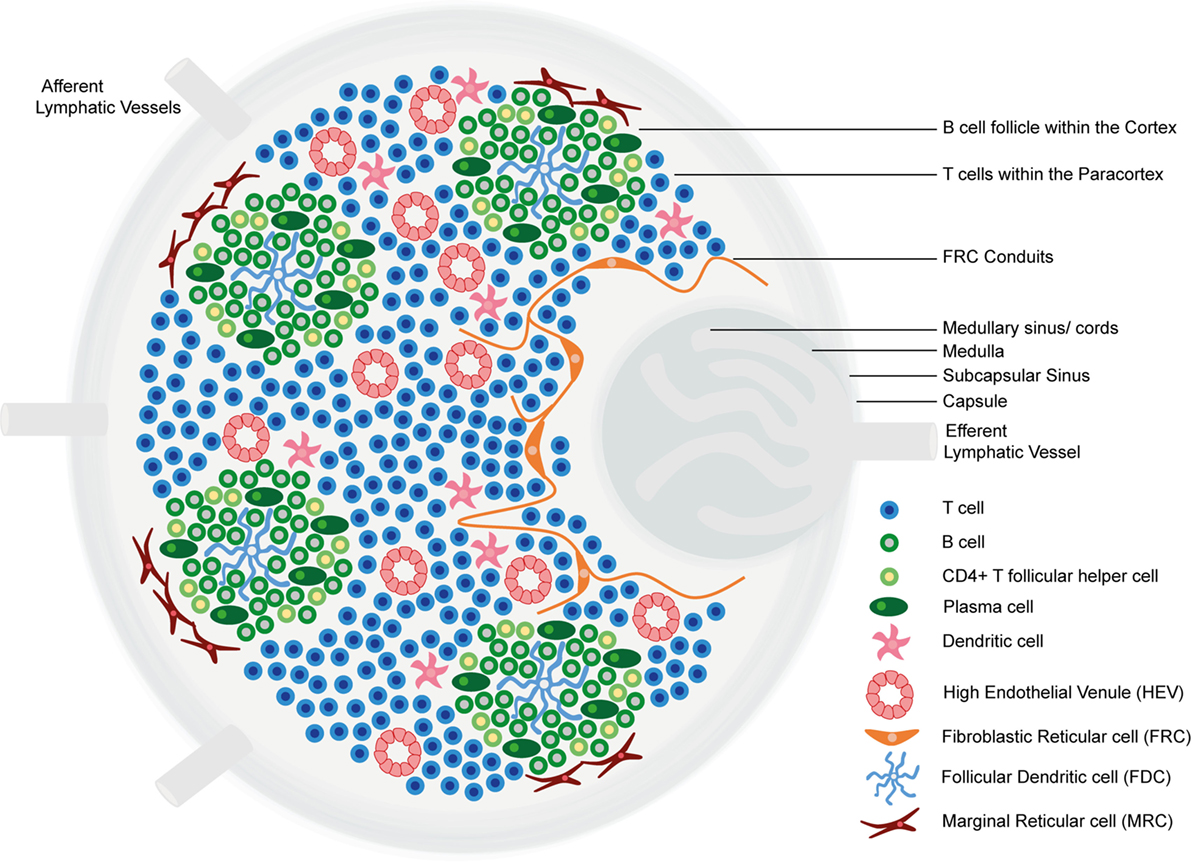
Estrutura e regiões funcionais de um nódulo linfático: formado por uma cápsula fibrosa rica em colagénio e um seio subcapsular (SCS, pela sigla em inglês) subjacente.
As células são secretadas no (1) córtex (constituído por células B, células T auxiliares foliculares e células dendríticas foliculares [FDCs, pela sigla em inglês], dispostos em folículos primários, nos quais as células B pesquisam os antigénios presentes na rede estromal da FDC); e (2) no paracórtex (que contém células T, células dendríticas [DCs, pela sigla em inglês] e células reticulares fibroblásticas [FRCs, pela sigla em inglês], que formam redes de células estromais e fibras reticulares).
A medula interna é composta por tecidos linfáticos (cordões medulares) separados por seios medulares constituídos por linfa.
A ativação de células B por apresentação de antigénio pode ocorrer através de diferentes vias:
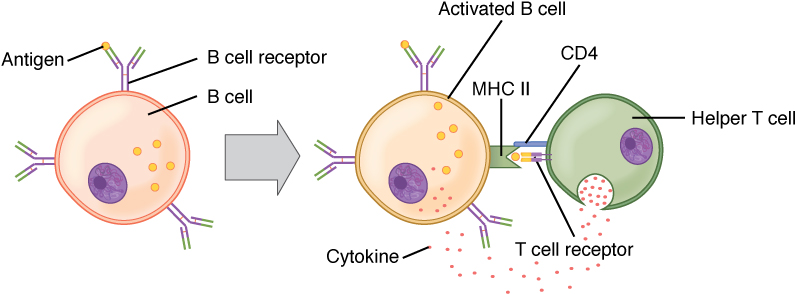
Ativação de células B (dependente de células T):
O antigénio circulante interage com o BCR da célula B. O antigénio é endocitado e degradado, e os componentes peptídicos são complexados com moléculas MHC II da superfície celular. As células T auxiliares foliculares (Tfh) (células T auxiliares especializadas CD4+) reconhecem e ligam-se ao complexo antigénio-MHC II. As citocinas são libertadas pelas células Tfh, levando à ativação e proliferação das células B. As células B ativadas entram nos centros germinativos, onde sofrem diferenciação.
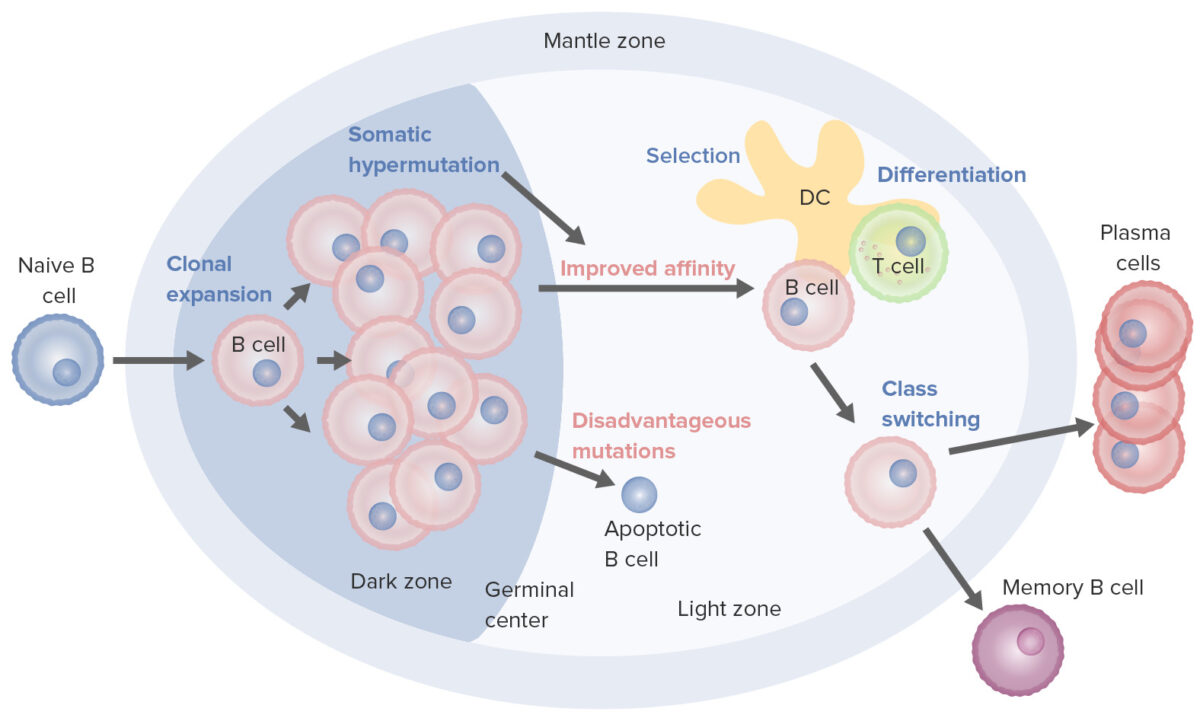
Processos de ativação e maturação de células B que ocorrem no centro germinativo:
Na ativação, a célula B desloca-se da zona do manto e entra no centro germinativo. Dá-se a proliferação de células B (expansão clonal) e o aumento da afinidade do anticorpo para o antigénio, através do processo de hipermutação somática. Os ciclos repetidos de proliferação e hipermutação ajustam o recetor de células B. Contudo, nem todas as células B continuam a diferenciação, sobretudo se a afinidade for fraca. Se a ligação antigénio-anticorpo não for adequada pode ocorrer a apoptose. As células com forte afinidade sobrevivem (seleção) com a ajuda de sinais de sobrevivência de células dendríticas foliculares e células T. Estas células B selecionadas seguem para a mudança de classe e diferenciação em células plasmáticas ou células de memória.
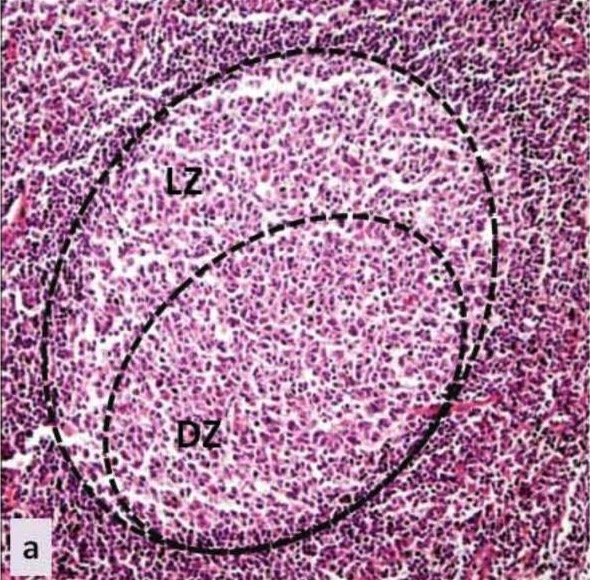
Centro germinativo: imagem histológica do centro germinativo de um tecido linfoide secundário
LZ: zona clara
DZ: zona escura
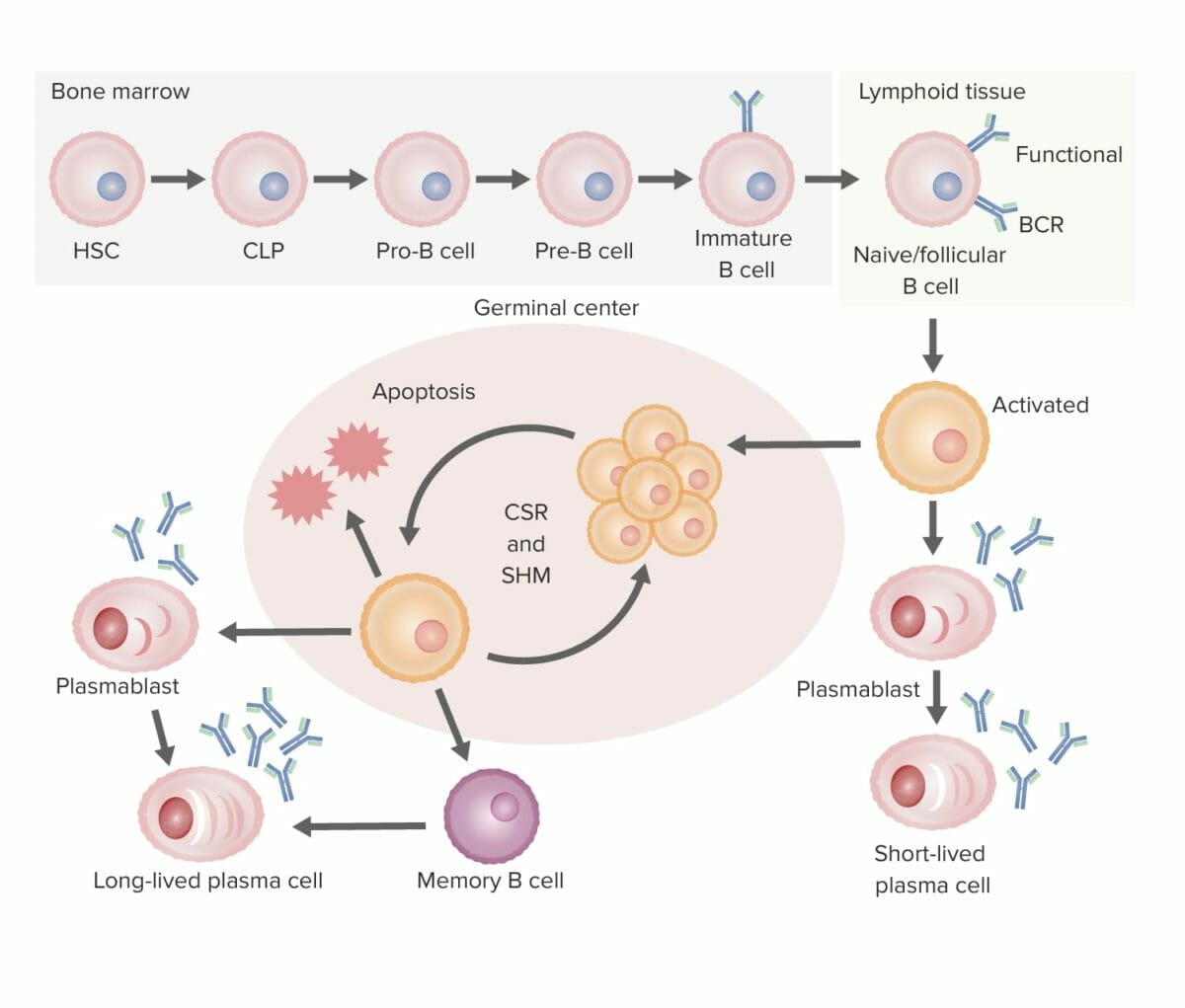
Resumo do desenvolvimento de células B até à sua diferenciação (da medula óssea ao órgão linfoide secundário):
Desenvolvimento de células B:
Na medula óssea, as células B transformam-se em células B imaturas, processo no qual é formado o recetor de células B (BCR). De seguida, a célula B migra para os órgãos linfoides secundários, onde ocorre a ativação.
Ativação de células B:
O antigénio liga-se à célula B com o BCR de maior afinidade. A ativação por ser independente de células T, quando a célula B ativada se diferencia numa célula plasmática de vida curta (produzindo anticorpos) sem a ajuda da célula T, ou dependente de células T, que reconhecem o antigénio-MHC II, desencadeando a proliferação da célula B no centro germinativo do tecido linfoide.
Proliferação e maturação:
Posteriormente ocorre hipermutação somática (SHM; uma mutação programada para ajustar ainda mais a afinidade do anticorpo para o antigénio), que consiste em ciclos repetidos de proliferação e hipermutação para aperfeiçoamento do BCR. São selecionados apenas aqueles com maior afinidade; os com baixa afinidade sofrem apoptose. As células B sobreviventes passam então pela recombinação de troca de classe (CSR), na qual a composição da cadeia pesada é alterada (IgM para outros isotipos) com a ajuda de citocinas.
Diferenciação:
As células B diferenciam-se em plasmócitos e células de memória, abandonando o centro germinativo.
A partir da produção inicial de células B, existem diversos processos que permitem que os humanos produzam diferentes moléculas de anticorpos que são significativamente maiores do que o número de genes Genes A category of nucleic acid sequences that function as units of heredity and which code for the basic instructions for the development, reproduction, and maintenance of organisms. DNA Types and Structure no genoma.
Estima-se que sejam gerados bilhões de anticorpos, em comparação com cerca de 30.000 genes Genes A category of nucleic acid sequences that function as units of heredity and which code for the basic instructions for the development, reproduction, and maintenance of organisms. DNA Types and Structure.
O sistema imunológico possui mecanismos únicos para criar diversidade de anticorpos, tais como: