Os aminoácidos (AAs) podem ser adquiridos através da degradação de proteínas intracelulares ou ingeridas na dieta. Os aminoácidos podem entrar em 3 vias metabólicas dentro do corpo. Estes podem 1) ser reciclados para sintetizar novas proteínas; 2) combinar com cofatores e substâncias para criar derivados de aminoácidos; ou 3) ser catabolizados nos seus grupos funcionais e esqueletos de carbono. Este processo liberta amónio, que entra no ciclo da ureia e produz intermediários para as vias metabólicas energéticas.
Última atualização: Dec 12, 2024
Os aminoácidos (AAs) seguem 3 vias metabólicas principais para o seu metabolismo:
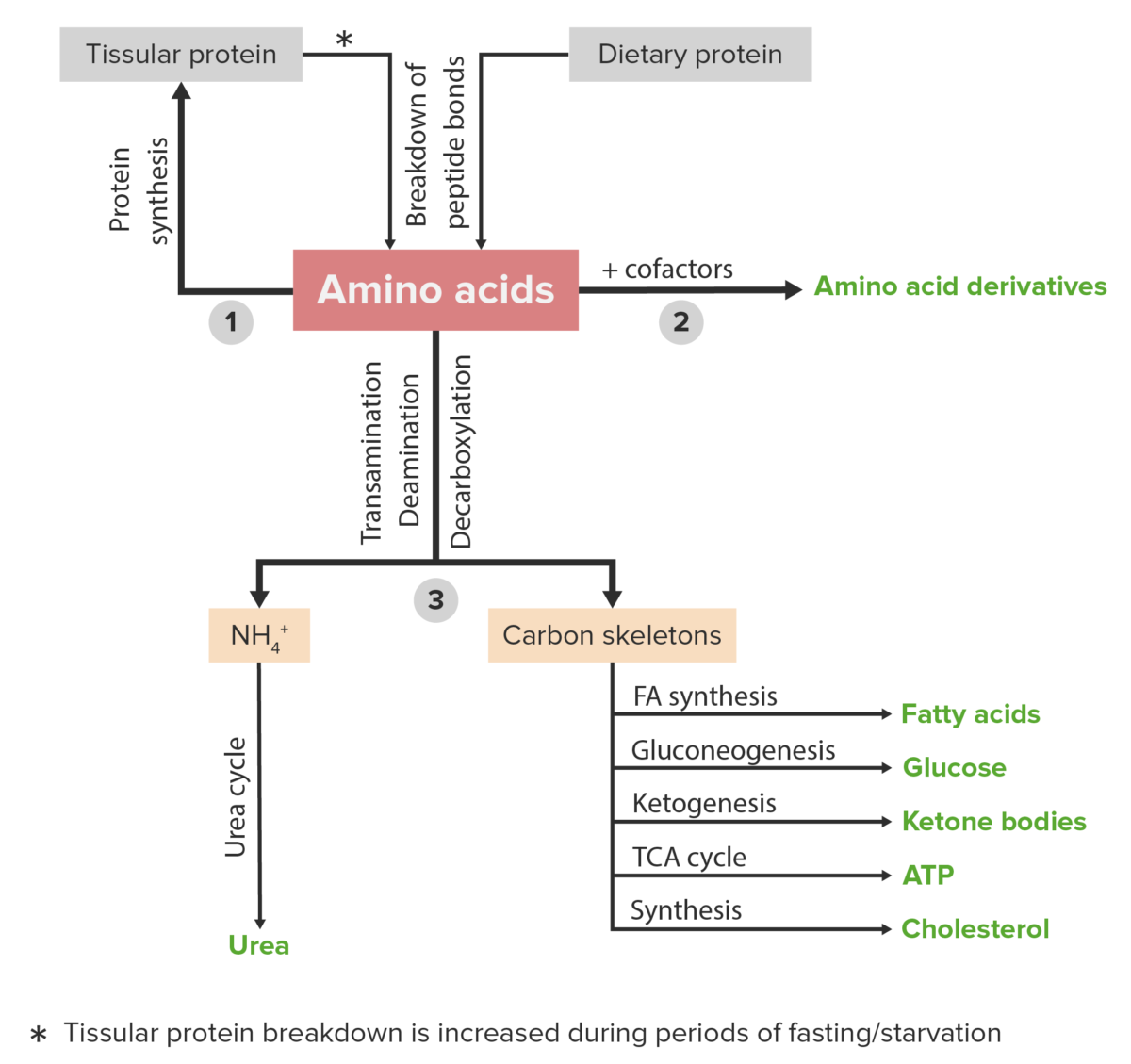
Diagrama esquemático do metabolismo dos aminoácidos, incluindo as 3 principais vias: reutilização na síntese de novas proteínas, união com cofatores para produção de derivados de aminoácidos e catabolismo. O catabolismo de aminoácidos inclui a remoção de grupos funcionais e a degradação dos esqueletos de carbono.
Os aminoácidos podem ser usados para agrupar muitas substâncias. A imagem abaixo mostra as substâncias derivadas de AA mais importantes em humanos.
A transaminação é a transferência de um grupo amina de um alfa-AA para um alfa-cetoácido, um AA com um grupo alfa-ceto (=O) em vez de um grupo alfa-amina (NH 2 ).
Este processo depende da necessidade. Se houver excesso de um tipo de AA, o grupo amina deste tipo pode ser transferido para fazer outros tipos de AA que o corpo necessita.
Todos os AAs comuns participam da transaminação, exceto lisina, treonina, prolina e hidroxiprolina, que catabolizam via desidrogenase.
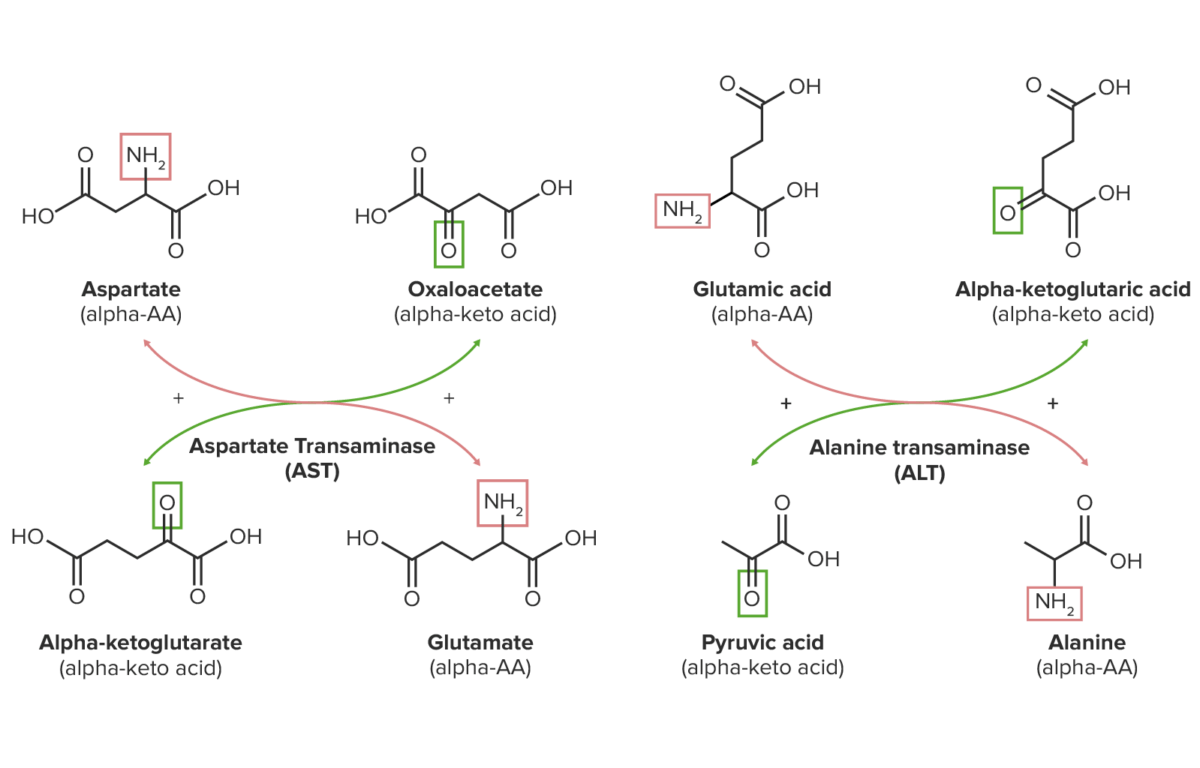
Diagrama esquemático das reações de transaminação de aspartato e glutamato (ácido glutâmico): Os grupos amina estão destacados a vermelho, enquanto os grupos ceto estão destacados a verde.
Imagem por LecturioAmbas as enzimas catabolizam reações reversíveis, que são essenciais para o transporte de nitrogénio dos tecidos para o fígado e para o ciclo da ureia.
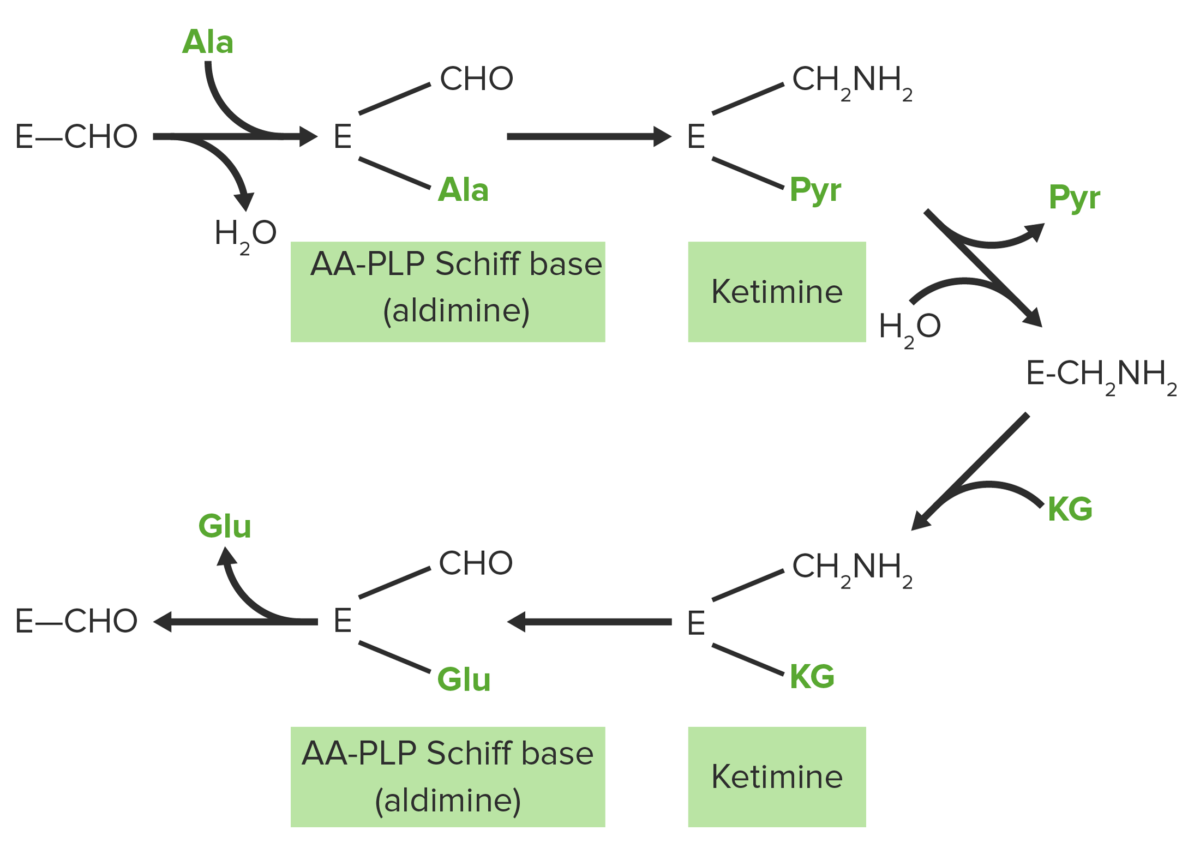
Mecanismo “bi-bi de pingue-pongue” de transaminação catalisada por enzima dependente de PLP. A reação da aminotransferase ocorre em 2 etapas que consistem em 3 etapas: transaminação, tautomerização e hidrólise. Na primeira etapa, o grupo alfa-amina do aminoácido é transferido para o PLP, produzindo um alfa cetoácido e fosfato de piridoxamina (PMP). Na segunda etapa da reação, o grupo amina de PMP é transferido para um alfa-cetoácido diferente para produzir um novo alfa-aminoácido e PLP.
Imagem por Lecturio.Etapas :
A desaminação é o processo pelo qual os grupos amino são retirados dos AAs, libertando amónia citotóxica livre: amónia → amónio → ureia ou ácido úrico através do ciclo da ureia no fígado.
1. Desaminação oxidativa:
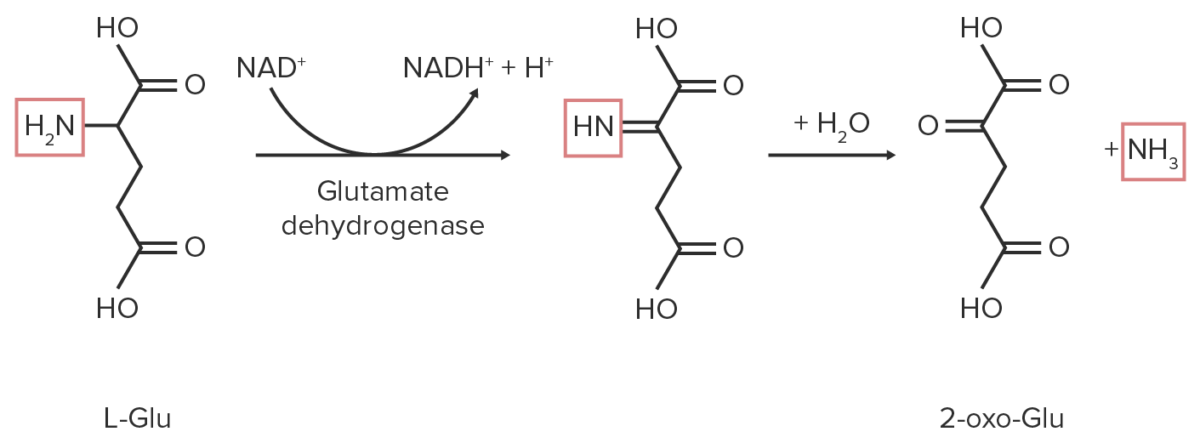
Diagrama esquemático da reação de desaminação oxidativa do glutamato. Os grupos funcionais que contêm nitrogénio estão destacados a vermelho.
Imagem por Lecturio.2. Desaminação hidrolítica:
A água reage com o grupo amina, ligando irreversivelmente um grupo OH e eliminando o grupo amina na forma de amónia.
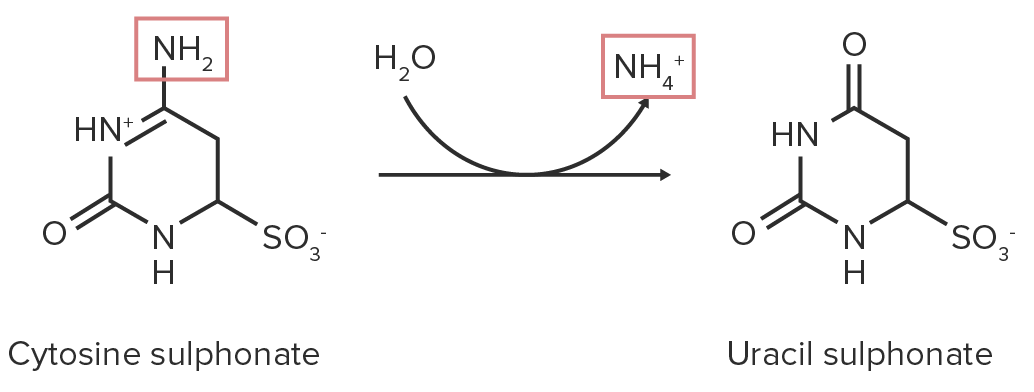
Diagrama esquemático de uma reação de desaminação hidrolítica. Os grupos funcionais que contêm nitrogénio estão destacados a vermelho.
Imagem por Lecturio.3. Desaminação eliminativa:
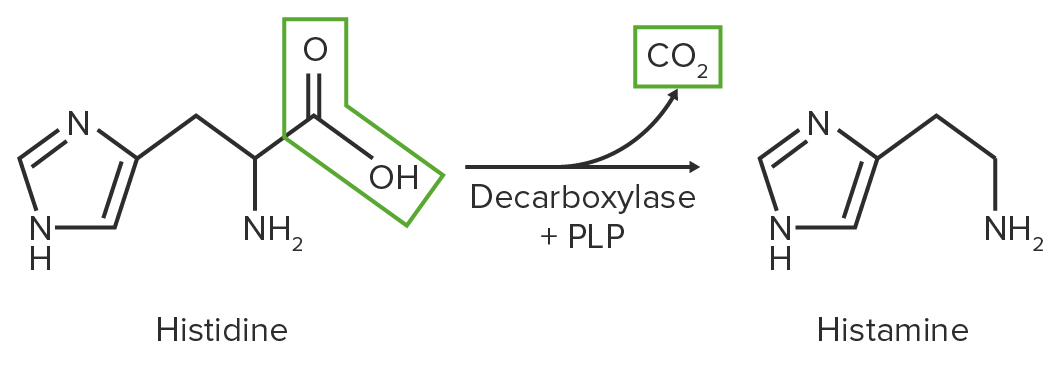
Diagrama esquemático da reação de descarboxilação de histidina em histamina
Imagem por Lecturio.O catabolismo dos AAs envolve reações anapleróticas (reações químicas que formam intermediários das vias metabólicas).
A degradação do esqueleto de carbono dos AAs pode ser classificada pelas vias metabólicas para as quais os seus produtos catabólicos servem como intermediários:
| AAs glicogénicos | AAs Cetogênicos | AAs Glicogénicos/Cetogénicos |
|---|---|---|
|
|
|
Todos os AAs são divididos em 1 de 6 intermediários (ver as caixas verdes nas imagens abaixo): piruvato, acetil-CoA, oxaloacetato, alfa-cetoglutarato, succinil-CoA ou fumarato.
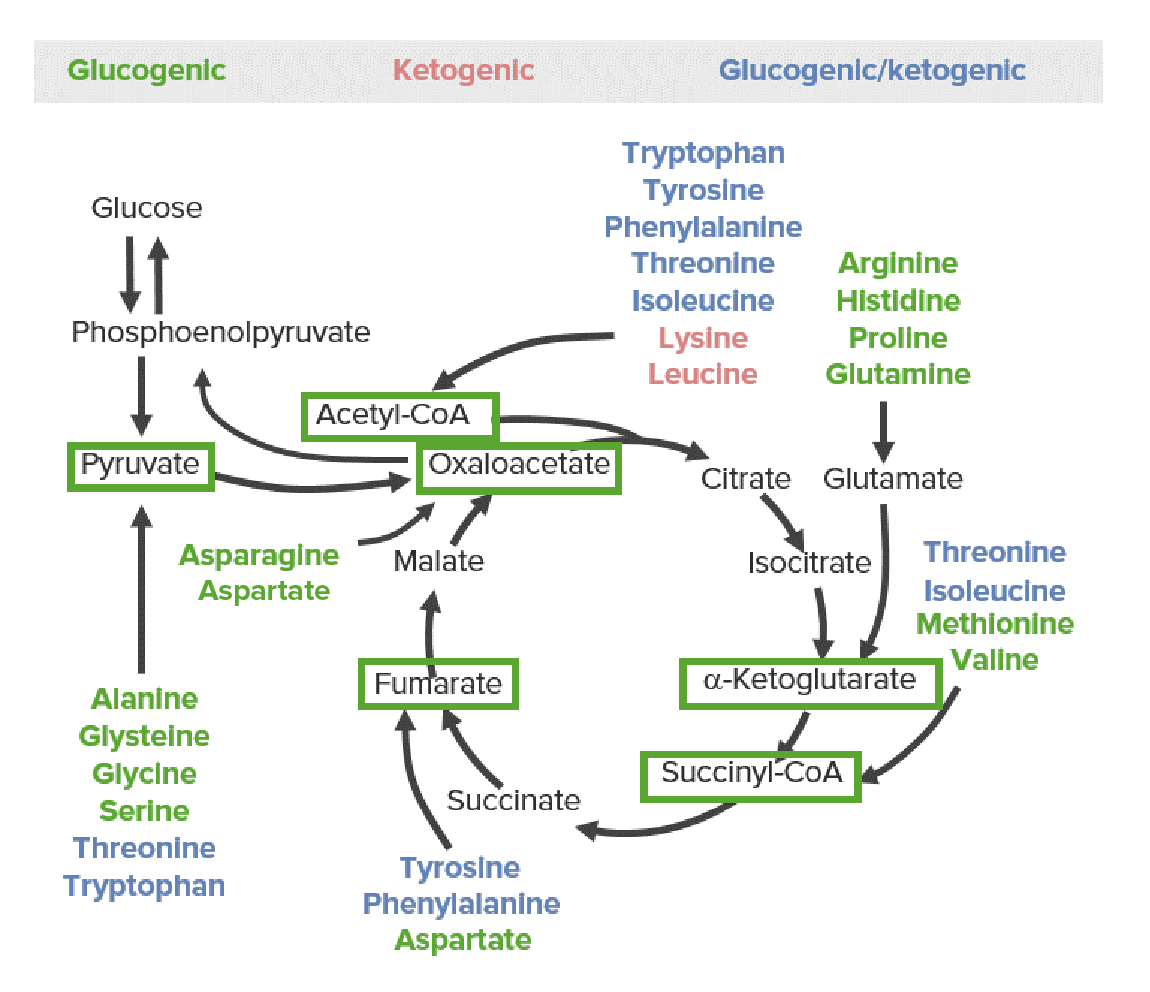
As 3 categorias de produtos catabólicos de aminoácidos: glicogénicos (verde), cetogénicos (vermelho) e glicogénicos e cetogénicos (azul). A via glicose-piruvato à esquerda representa a glicólise e a gliconeogénese. A via cíclica à direita representa o ciclo do ácido cítrico. Todos os aminoácidos são divididos em 1 de 6 intermediários (caixas verdes): piruvato, acetil-CoA, oxaloacetato, alfa-cetoglutarato, succinil-CoA ou fumarato.
AAs glicogénicos
Metabolizados em piruvato ou metabolitos do ciclo do ácido cítrico (CAC):
Os produtos catabólicos movem-se para o CAC para produzir energia ou são usados como substratos para a gliconeogénese.
AAs cetogénicos
Metabolizados diretamente em acetil-CoA, então entra em 1 de 3 vias metabólicas:
AAs glicogénicos e cetogénicos
Metabolizados em intermediários das vias lipídicas e glicogénicas:
Para relembrar as vias metabólicas dos esqueletos de carbono dos aminoácidos, lembrar:
As seguintes condições são doenças do metabolismo de aminoácidos . Dependendo do país e do estado dos EUA, os recém-nascidos podem ser examinados rotineiramente para estas doenças (exceto para alcaptonúria).