O carcinoma colorretal (CCR) é a segunda principal causa de mortes relacionadas com carcinomas nos Estados Unidos. O CCR é uma doença heterogénea que surge de anomalias genéticas e epigenéticas, com influência de fatores ambientais. Quase todos os casos de CCR são adenocarcinomas, sendo a maioria das lesões decorrentes da transformação maligna de um pólipo adenomatoso. Como a maioria dos casos de CCR são assintomáticos, a colonoscopia de rastreio ou exames às fezes são geralmente recomendados em doentes com ≥ 45 anos. Tal como o rastreio, o diagnóstico é feito pela realização de uma colonoscopia, que permite a visualização e a biópsia de tecidos. O tratamento é principalmente cirúrgico, com quimioterapia reservada para a doença avançada.
Last updated: Dec 15, 2025
Tipos de pólipos:
Pólipos de alto risco:
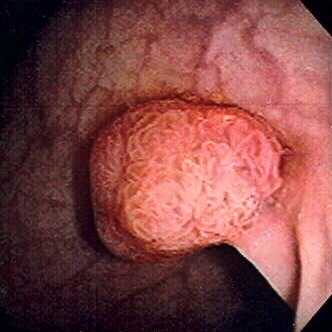
Pólipo do cólon sigmóide revelado por colonoscopia: O pólipo é pedunculado (com uma haste curta).
Imagem : “Colon polyp” por Dr. F.C. Turner. License: CC BY 2.5A maioria dos pólipos são benignos. A transformação maligna é afetada por uma série de mutações e fatores ambientais.
Mutações :
Gene APC (“adenomatous polyposis coli”):
Adenomatous poliposis coli é uma mutação genética inicial.
São necessários múltiplos hits genéticos para a progressão do CCR.
Acumulação de mutações e eventos moleculares:
A acumulação de mutações e eventos moleculares (por exemplo, alteração genética, metilação do DNA DNA A deoxyribonucleotide polymer that is the primary genetic material of all cells. Eukaryotic and prokaryotic organisms normally contain DNA in a double-stranded state, yet several important biological processes transiently involve single-stranded regions. DNA, which consists of a polysugar-phosphate backbone possessing projections of purines (adenine and guanine) and pyrimidines (thymine and cytosine), forms a double helix that is held together by hydrogen bonds between these purines and pyrimidines (adenine to thymine and guanine to cytosine). DNA Types and Structure, sobreexpressão) contribui para a carcinogénese.
Sobre-expressão da ciclooxigenase (COX)-2:
Sequência adenoma-carcinoma:
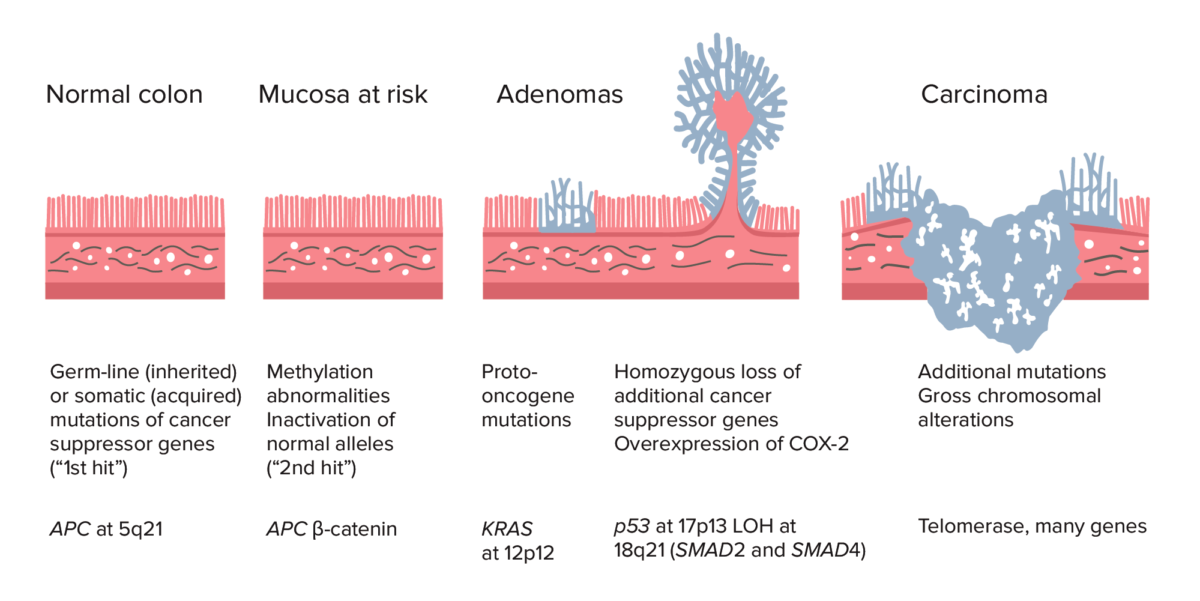
Sequência adenoma-carcinoma do cólon normal ao carcinoma: a formação do CCR inicia-se com a mutação do gene APC (herdado ou adquirido) e anomalias da metilação. Outras alterações podem incluir a mutação do gene KRAS. No final do processo, a deleção de p53, perda de heterozigotia (LOH) em 18q21 (envolvendo SMAD2 e SMAD4), com sobre-expressão de COX-2 pode contribuir para um maior crescimento e progressão para carcinoma. A acumulação de mutações, ao invés do momento da sua ocorrência, é mais crucial na carcinogénese.
Imagem por Lecturio.Via do pólipo serreado:
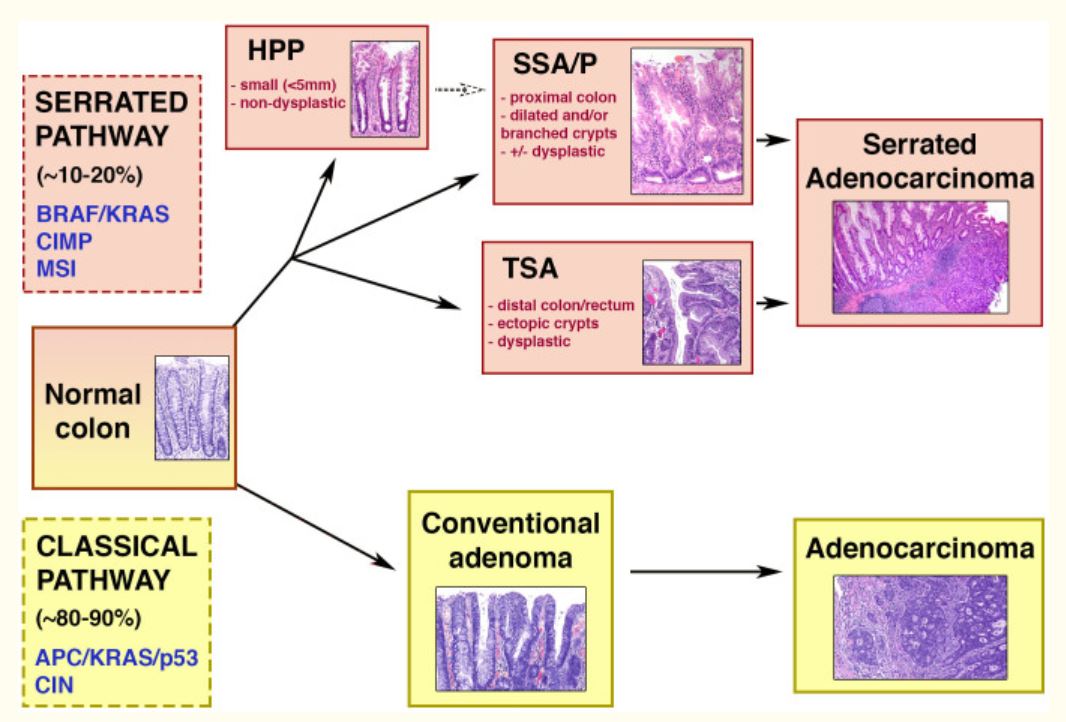
Diagrama esquemático das vias clássica (adenoma-carcinoma) e serreada.
Metade superior: via serreada da carcinogénese colorretal, que ocorre em 10-20% dos CCR. A via está associada às seguintes características genéticas: mutações BRAF/KRAS, MSI (instabilidade de microssatélites) e CIMP (fenótipo metilador da ilha CpG). As lesões serreadas podem ser pólipos hiperplásicos, adenomas/pólipos serreados sésseis (SSA/Ps) e adenomas serrilhados tradicionais (TSAs). Os 2 últimos estão associados a displasia e progressão para carcinoma.
Metade inferior: adenoma-carcinoma ou via clássica, que ocorre na maioria dos CCR. Entre as características genéticas estão mutações nos genes APC/KRAS/p53 e instabilidade cromossómica (CIN). Através desta sequência, o adenoma torna-se adenocarcinoma.
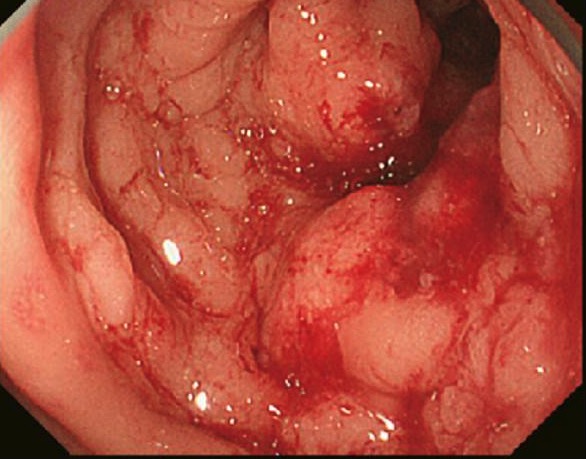
Carcinoma do cólon encontrado na colonoscopia e confirmado por biópsia
Imagem: “Primary tumor” por Second Department of Surgery, Wakayama Medical University, School of Medicine, 811-1 Kimiidera, Wakayama 641-8510, Japan. License: CC BY 2.0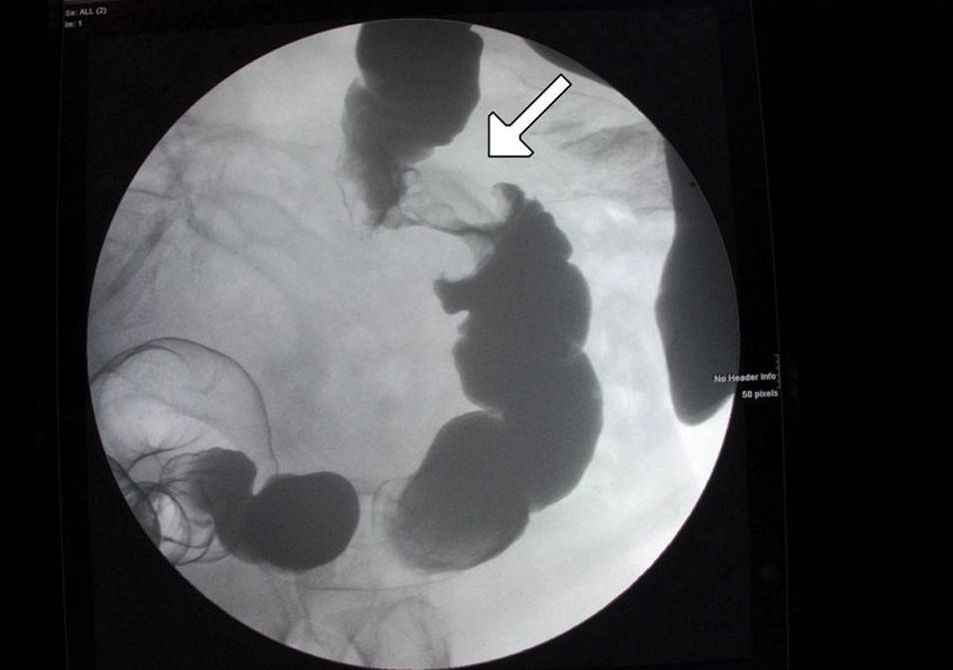
Uma lesão “apple core” do cólon mostrada no enema de contraste: isto deve sinalizar um eventual carcinoma.
Imagem: “Figure 6” por Alzaraa et al. License: CC BY 3.0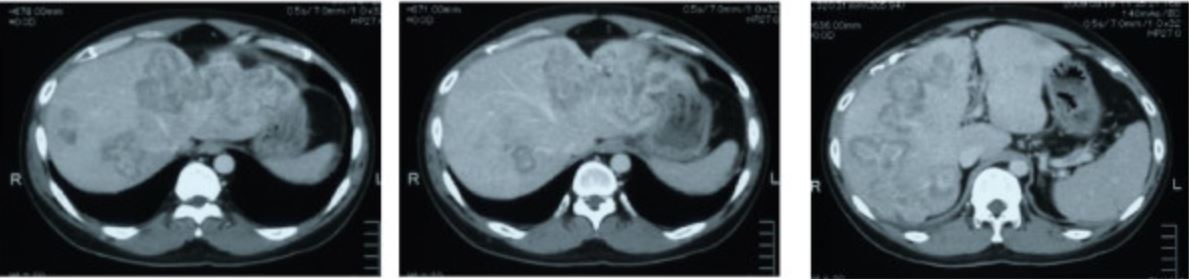
Metástases em TC de carcinoma do cólon sigmóide
Imagem: “CT scan showing liver metastasis from sigmoid colon cancer” por Department of Surgery, The Jikei University Kashiwa Hospital, Kashiwashita, Kashiwa City, Japan. License: CC BY 2.0Após se estabelecer o diagnóstico de CCR, é necessário o estadiamento da doença para o tratamento adequado.
Sistema de estadiamento TNM ( tumor Tumor Inflammation, nódulos, metástases):
| Estadio | Tumor Tumor Inflammation (T) | Nódulos regionais (N) | Metástases à distância (M) |
|---|---|---|---|
| Estadio 0 |
|
|
|
| Estadio I |
|
|
|
| Estadio II |
|
|
|
| Estadio III |
|
|
|
| Estadio IV |
|
|
|
O estadio do CCR e a biologia molecular (no caso da terapêutica dirigida) ditam os papéis dos tratamentos cirúrgicos e farmacológicos.
Antigénio carcinoembrionário ( CEA CEA A glycoprotein that is secreted into the luminal surface of the epithelia in the gastrointestinal tract. It is found in the feces and pancreaticobiliary secretions and is used to monitor the response to colon cancer treatment. Serum Tumor Markers):
Colonoscopia:
Imagiologia:
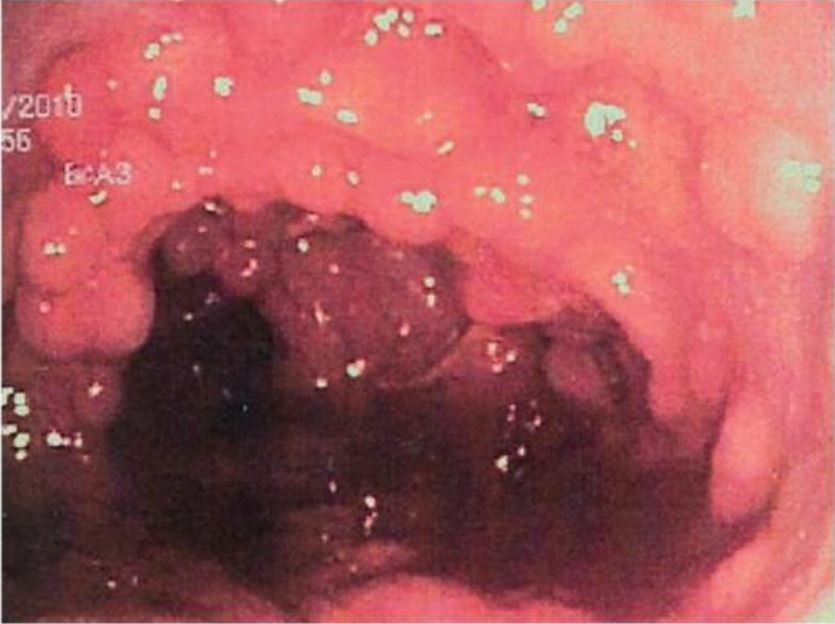
Mucosa do cólon coberta por pólipos adenomatosos na polipose adenomatosa familiar (PAF)
Imagem: “Colonic mucosa carpeted by adenomatous polyps in familial adenomatous polyposis FAP” por Shussman N., Wexner SD. License: CC BY 3.0
Visão endoscópica de múltiplos adenomas estabelecidos na PAF
Imagem: “Endoscopic view of established, multiple FAP adenomas” por Bercovich D., Rozen P. License: CC BY 2.0