Bunyaviridae é uma família de vírus de RNA classificada em 5 géneros: Orthobunyavirus (vírus La Crosse), Hantavirus, Nairovirus (vírus da febre hemorrágica da Crimeia-Congo), Phlebovirus (vírus da febre do Vale do Rift) e Tospovirus. As características comuns desta família de vírus incluem uma estrutura esférica com invólucro contendo um genoma de RNA de cadeia simples e sentido negativo, com 3 segmentos. As infeções são geralmente transmitidas por artrópodes ou por roedores. Existem várias manifestações clínicas, mas, em geral, apresentam-se como febres hemorrágicas e/ou encefalites. Os exames de diagnóstico incluem a serologia e o RT-PCR. O tratamento é de suporte.
Última atualização: Feb 23, 2025
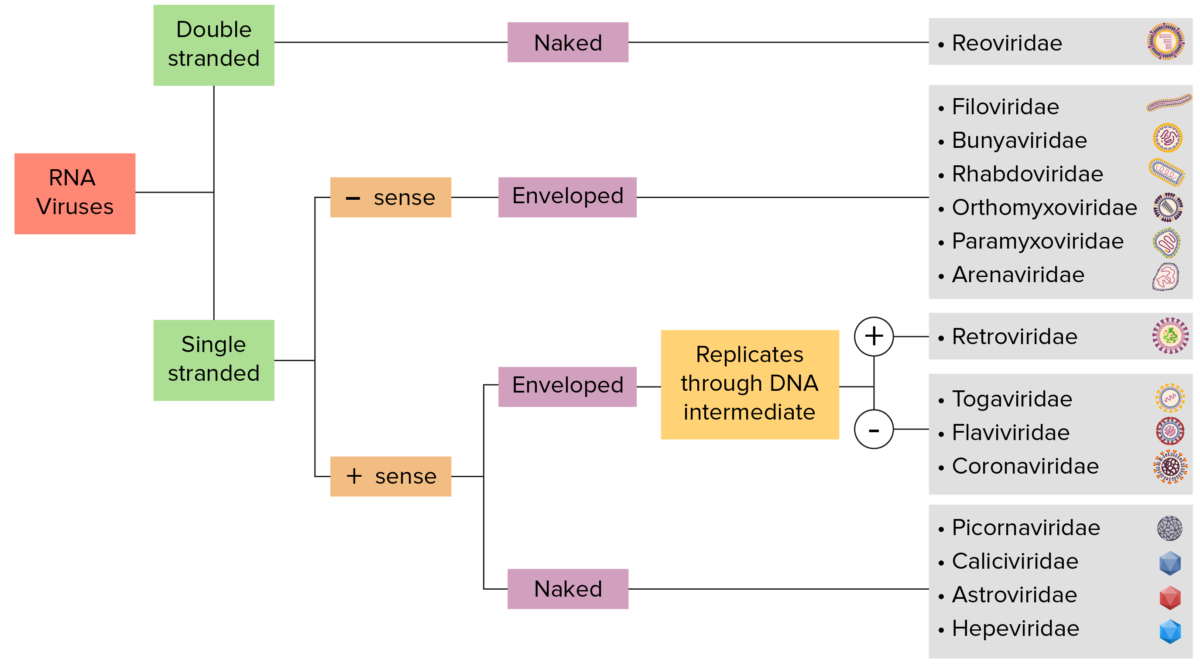
Identificação do vírus RNA:
Os vírus podem ser classificados de várias maneiras. A maioria dos vírus, no entanto, terá um genoma formado por DNA ou RNA. Os vírus de genoma de RNA podem ser ainda caracterizados com base na presença de RNA de fita simples ou dupla. Os vírus “envelopados” são cobertos por uma fina camada de membrana celular (geralmente retirada da célula hospedeira). Se a pelagem estiver ausente, os vírus são chamados de vírus “nus”. Vírus com genomas de fita simples são chamados de vírus de “sentido positivo” se o genoma for usado diretamente como RNA mensageiro (mRNA), que é traduzido em proteínas. Os vírus de “sentido negativo” de fita simples usam RNA polimerase dependente de RNA, uma enzima viral, para transcrever seu genoma em RNA mensageiro.
Imagem de uma partícula do vírus Sin Nombre a sair de uma célula Vero:
O vírus Sin Nombre causa a síndrome pulmonar por hantavírus na América do Norte.
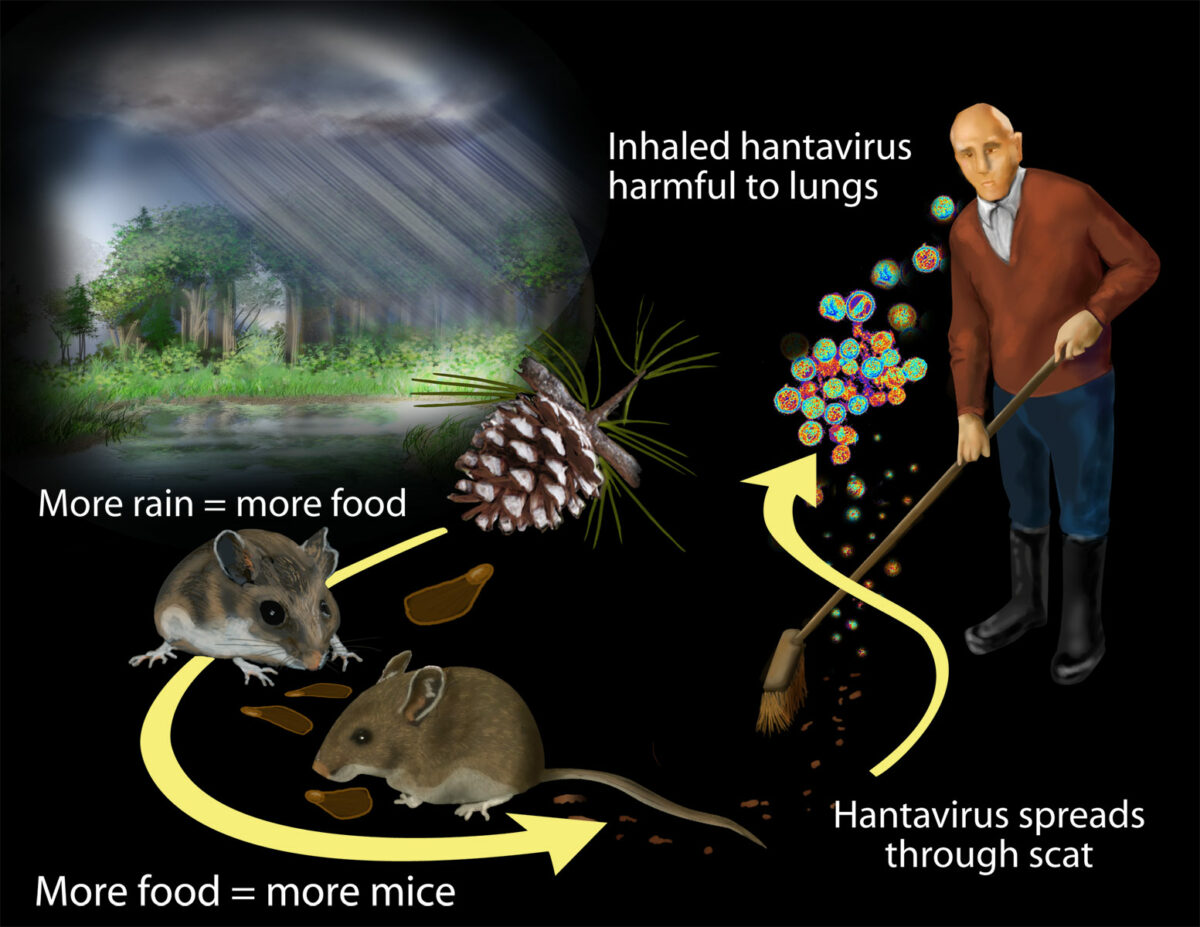
Transmissão do hantavírus:
Os investigadores descobriram que o contacto com roedores e respetivos resíduos coloca os humanos em risco de exposição ao hantavírus. As chuvas maciças associadas ao El Niño de 1991–1992 aumentaram a produtividade das plantas.
A população de roedores cresceu devido à abundância de matéria vegetal. O aumento do contacto com os roedores e os seus resíduos coloca mais humanos em risco de exposição ao hantavírus.
| Síndrome pulmonar por hantavírus | Febre hemorrágica por hantavírus | |
|---|---|---|
| Incubação | 1-3 semanas | 1-3 semanas (até 6 semanas) |
| Diagnóstico |
|
|
| Manifestações clínicas | Pródromo: sintomas gripais, início súbito de dispneia com edema pulmonar de evolução rápida | Febre, hipotensão/choque, LRA |
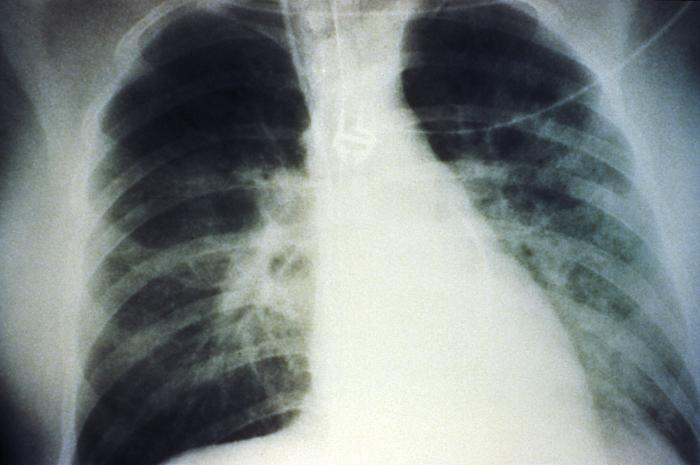
Radiografia de tórax anteroposterior que mostra um derrame pulmonar bilateral em fase intermédia devido à síndrome pulmonar por hantavírus (HPS):
A evolução radiológica da HPS inicia-se com alterações mínimas correspondentes a edema pulmonar intersticial, que progride para edema alveolar com atingimento bilateral grave. Os derrames pleurais são comuns e muitas vezes grandes o suficiente para serem evidentes radiograficamente.
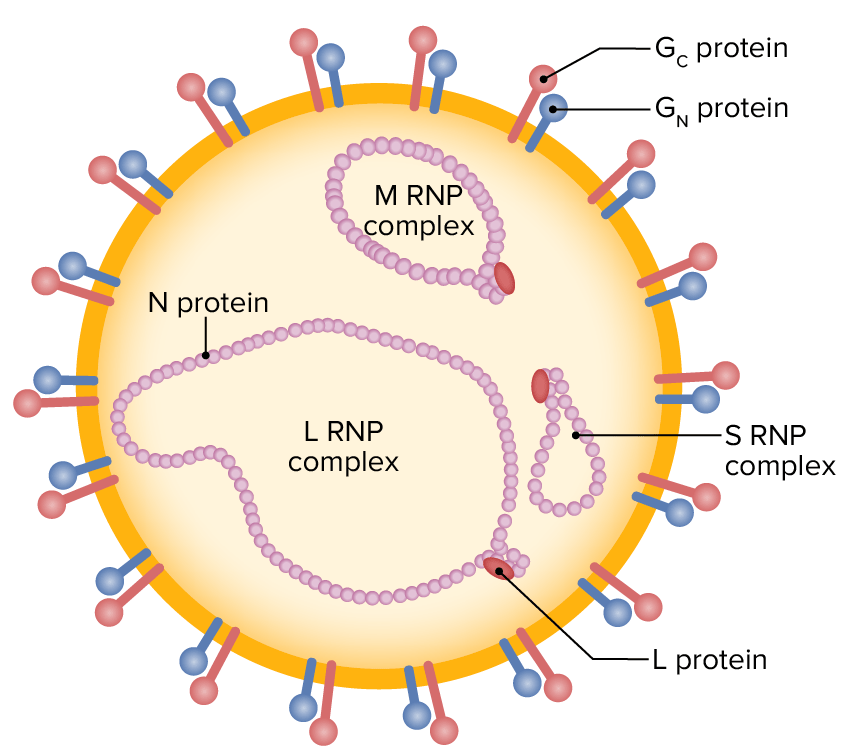
Ilustração esquemática de uma partícula de nairovírus (RNA de cadeia única envelopado, contendo segmentos L, M, e S, rodeado por glicoproteínas externas)
RNP: ribonucleoproteína
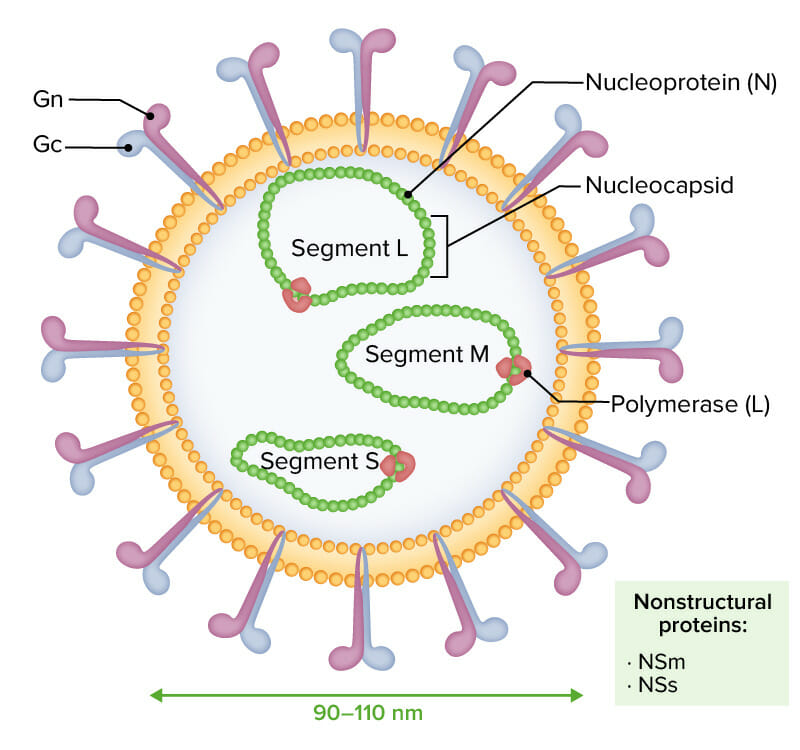
Os viriões envelopados do vírus da febre do Vale do Rifte caracterizam-se por um genoma RNA negativo ou ambisenso composto por 3 segmentos de cadeia simples (designados L, M, e S):
As 3 moléculas de RNA são encapsuladas por nucleoproteína (N), moldando a nucleocápside e interagindo com a polimerase viral (L). As glicoproteínas Gn e Gc são notadas externamente. As proteínas não-estruturais NSm e NSs são expressas durante a infeção.
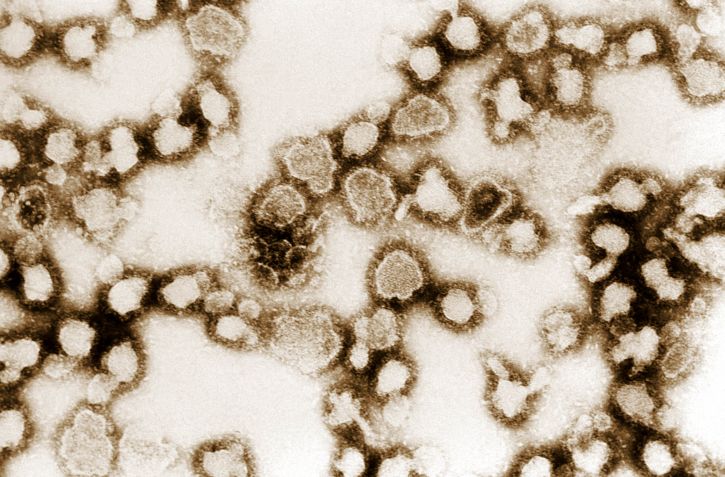
Imagem que mostra a morfologia ultraestrutural de numerosas partículas do vírus La Crosse (LCV)
Imagem: Image showing the ultrastructural morphology exhibited by numerous La Crosse virus (LCV) particles” de Dr. Erskine Palmer, USCDCP. Licença: Domínio Público| Organismo | Hantavírus | Vírus da febre hemorrágica da Crimeia-Congo | Vírus da febre do Vale do Rift | Vírus La Crosse | |
|---|---|---|---|---|---|
| Características | Vírus de RNA de cadeia simples e sentido negativo, com invólucro | ||||
| Género | Hantavirus ou Ortohantavirus | Nairovirus | Phlebovirus | Orthobunyvirus | |
| Transmissão | Inalação e contacto direto com a urina e fezes de roedores infetados | Contacto com carraças infetadas (especialmente Hyalomma spp.) |
|
Picadas de mosquito | |
| Apresentação clínica |
|
Febre hemorrágica |
|
Encefalite | |
| Diagnóstico |
|
|
|
|
|
| Tratamento | Suporte |
|
Suporte | Suporte | |