Aciclovir, cidofovir e foscarnet são agentes antivirais contra vírus herpes humanos (HHVs, pela singla em inglês). Os vírus herpes humanos são vírus de DNA da família Herpesviridae. O vírus herpes simplex (VHS), vírus varicela-zoster (VZV), citomegalovírus (CMV), vírus Epstein-Barr (EBV) e HHV-8 pertencem à família Herpesviridae. Os antivirais atuam através da inibição da DNA polimerase. O aciclovir (protótipo de análogo de nucleosídeo) é fosforilado em trifosfato por atuação da quinase viral, que é incorporado no DNA viral. O cidofovir é fosforilado pela quinase celular do hospedeiro e não viral, conferindo-lhe atividade contra vírus mutantes. O antiviral foscarnet (análogo de pirofosfato) não requer fosforilação. A nefrotoxicidade é um efeito adverso comum em todos. O aciclovir também pode causar nefropatia cristalina obstrutiva e o foscarnet pode desenvolver distúrbios hidroeletrolíticos e convulsões. O efeito nefrotóxico do cidofovir pode ser atenuado com a administração de soro fisiológico e probenecid.
Última atualização: May 23, 2022
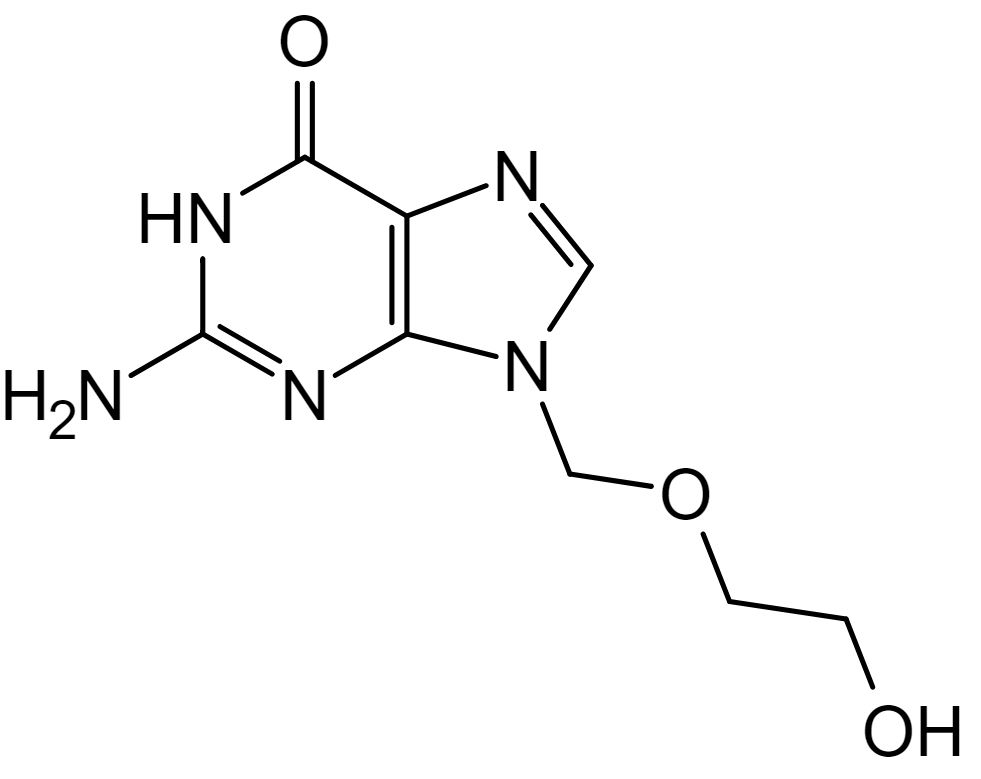
Estrutura química do aciclovir
Imagem: “Aciclovir structure” por Steffen 962. Licença: Domínio PúblicoAciclovir:
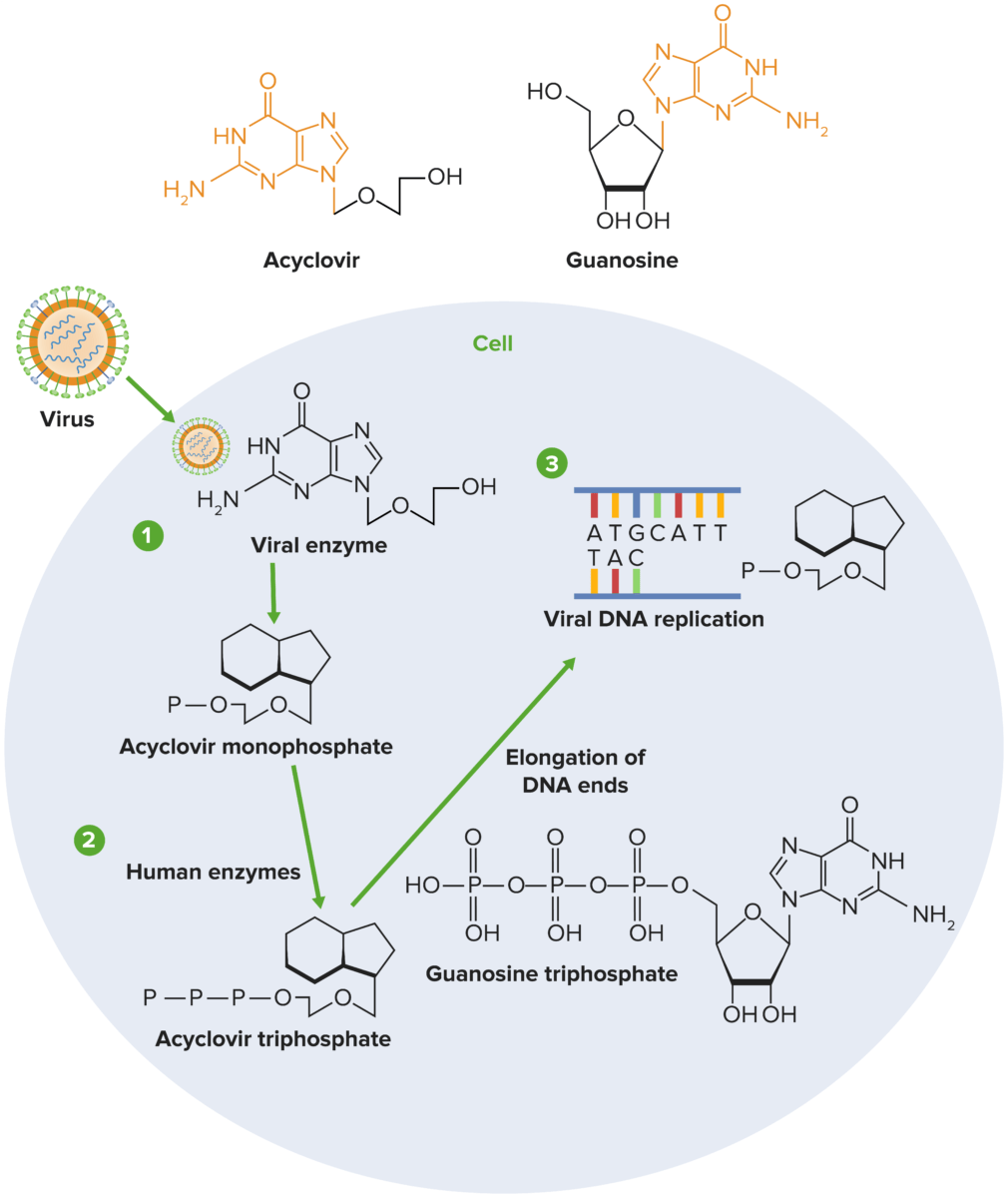
Mecanismo de ação do aciclovir:
1) O aciclovir sofre fosforilação sequencial, que é facilitada pela herpesvirus timidina cinase (TK, pela sigla em inglês) e pelas cinases do hospedeiro. Como a TK viral é necessária para a fosforilação do aciclovir, apenas as células infetadas pelo vírus são afetadas pelo fármaco.
2) As enzimas do hospedeiro convertem o monofosfato a aciclovir trifosfato, que subsequentemente compete com a desoxiguanosina trifosfato (dGTP) pela DNA polimerase viral.
3) O aciclovir é adicionado à cadeia em crescimento durante a replicação viral em vez da guanosina trifosfato (GTP), o que interrompe a replicação viral impedindo a elongação da molécula de DNA.
Aciclovir (e outros agentes relacionados):
Aciclovir:
| Agente | Características e mecanismo de ação | Farmacocinética | Indicação aprovada | Efeitos adversos |
|---|---|---|---|---|
| Aciclovir |
|
Baixa biodisponibilidade oral |
|
|
| Valaciclovir |
|
Boa biodisponibilidade oral | ||
| Penciclovir |
|
Formulação tópica | VHS (herpes labial) | Reações adversas ligeiras |
| Famciclovir |
|
Melhor biodisponibilidade oral do que o penciclovir |
|
|
| Ganciclovir |
|
|
Infeções por citomegalovírus (CMV) |
|
| Valganciclovir |
|
Melhor biodisponibilidade oral do que o ganciclovir |
O cidofovir é um análogo de nucleótido de citidina.
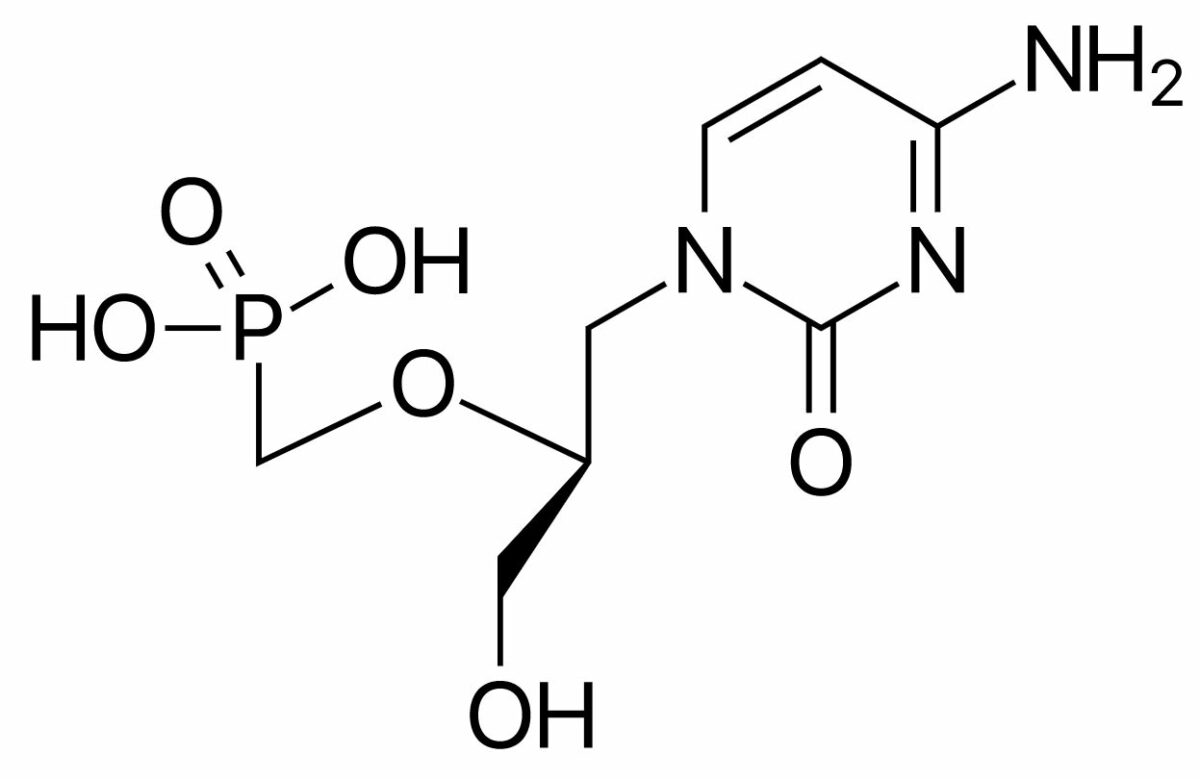
Estrutura química do cidofovir
Imagem: “Cidofovir” por ljfa-ag. Licença: Domínio PúblicoFoscarnet é um análogo de pirofosfato.
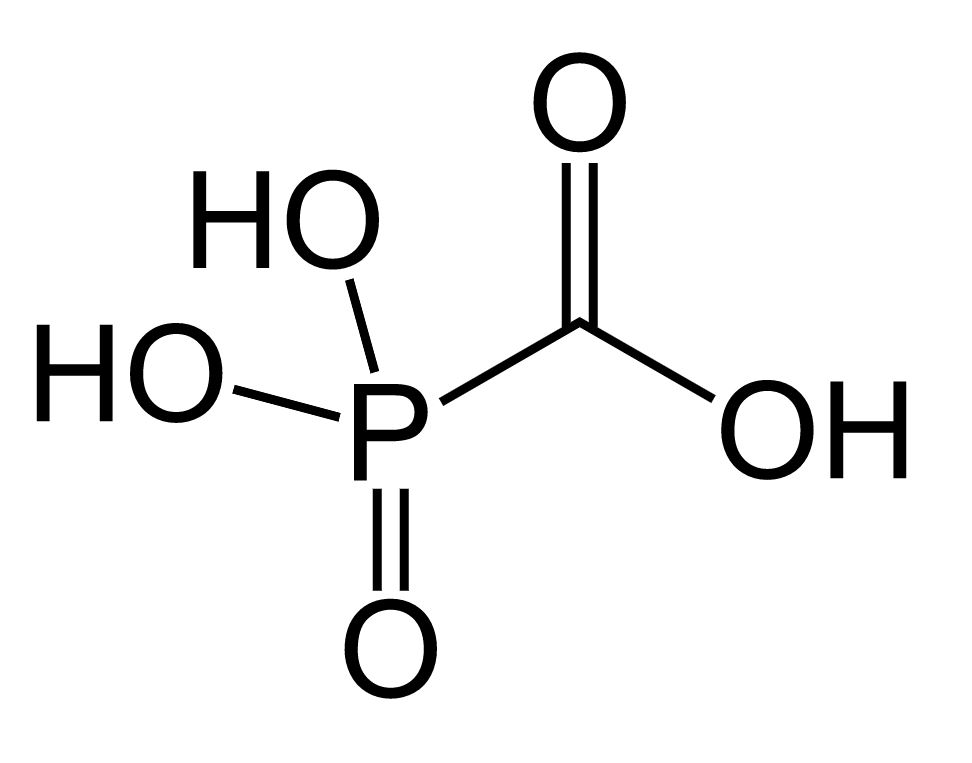
Estrutura química do foscarnet
Imagem: “Foscarnet” por Fvasconcellos. Licença: Domínio Público| Agente antiviral | Mecanismo de ação | Indicações | Efeitos adversos principais |
|---|---|---|---|
| Aciclovir (análogo de nucleosídeo) | Inibidor da polimerase que requer fosforilação pela enzima quinase viral |
|
Lesão renal aguda (nefropatia obstrutiva) |
| Cidofovir (análogo de nucleótido) | Inibidor da polimerase que requer fosforilação pela quinase hospedeira (e não quinase viral) | Aprovado no tratamento de retinite por CMV com atividade contra outros vírus* | Nefrotoxicidade (risco diminuído com administração de solução salina IV e probenecid) |
| Foscarnet (análogo de pirofosfato) | Inibidor da polimerase que não requer fosforilação | CMV e VHS resistentes |
|