El tumor de Wilms es una neoplasia causada por la proliferación del blastema metanéfrico en los riñones y es la neoplasia renal más común en los niños. El tumor de Wilms suele surgir de forma esporádica, pero también puede aparecer como resultado de una anomalía congénita específica como el síndrome WAGR (tumor de Wilms, aniridia, anomalías genitourinarias y retraso mental), el síndrome de Denys-Drash o el síndrome de Beckwith-Wiedemann. El tumor de Wilms suele presentarse como una masa firme, no sensible y lisa que no cruza la línea media. El tumor de Wilms también puede presentarse raramente con dolor abdominal, hematuria y/o hipertensión. La malignidad se diagnostica con ultrasonido abdominal y estudios histopatológicos (a partir de una biopsia o resección). El tumor de Wilms se trata con una terapia multimodal (cirugía, quimioterapia y/o radiación). Dependiendo de la edad del paciente, los marcadores moleculares y los hallazgos patológicos, el pronóstico es generalmente favorable, con tasas de supervivencia a los 5 años cercanas al 90%.
Última actualización: Mar 28, 2025
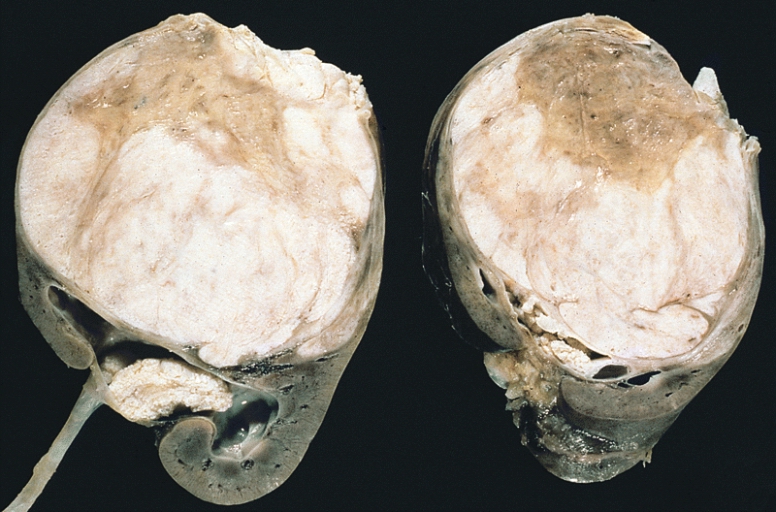
Tumor de Wilms:
Obsérvense los prominentes septos que subdividen la superficie seccionada y la protrusión del tumor en la pelvis renal, que se asemeja a un rabdomiosarcoma botrioide.
Ultrasonido abdominal seriado para los que tienen riesgo de tumor de Wilms:
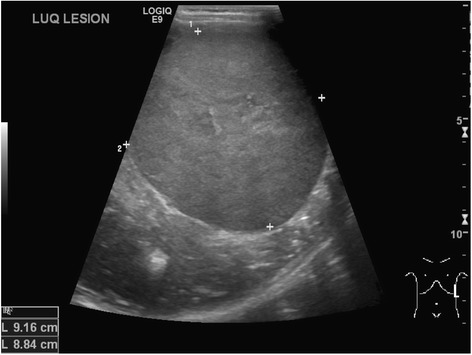
Ultrasonido abdominal que revela un tumor de Wilms del lado izquierdo en un niño de 4 años
Imagen: “Neuroblastoma and nephroblastoma: a radiological review” por Dumba M, Jawad N, McHugh K. Licencia: CC BY 4.0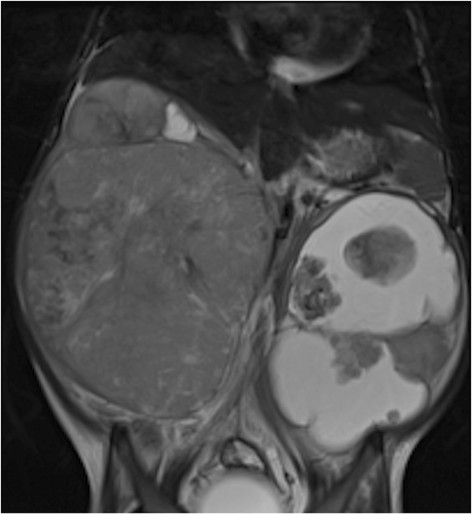
RM de un tumor de Wilms: niña de 4 años con tumor de Wilms bilateral, más quístico en la izquierda
Imagen: “Figure 11” por Dumba, M. et al. Licencia: CC BY 4.0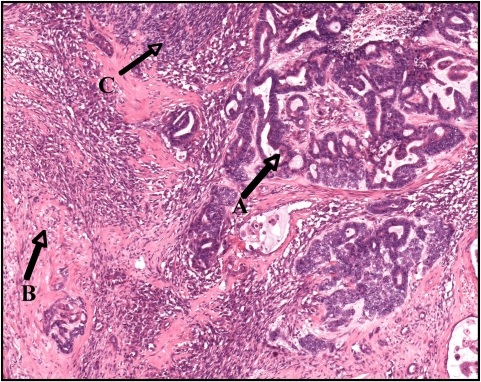
Tumor de Wilms con componente epitelial (A), componente estromal (B) y pequeñas áreas de blastema (C)
Imagen: “Wilms tumor in a 37-year-old” por Thevendran G, Farne HA, Kaisary AV. Licencia: CC BY 2.0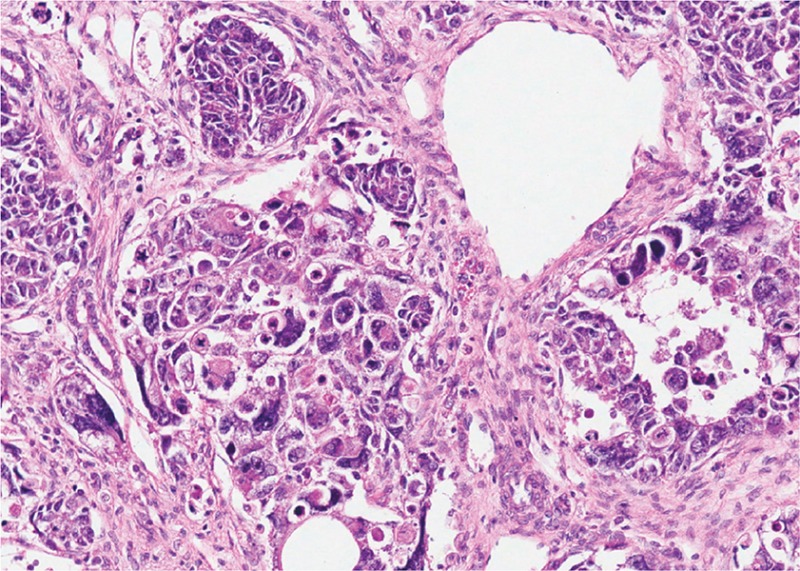
Examen histopatológico de la biopsia de un tumor de Wilms con anaplasia
Imagen: “Wilms tumour with anaplasia” por van den Heuvel-Eibrink, MM. Licencia: CC BY 4.0Del National Wilms Tumor Study (NWTS, por sus siglas en inglés)/Children’s Oncology Group (COG, por sus siglas en inglés):
Recomendaciones basadas en los ensayos del NWTS/COG: