La trombocitemia esencial es un tipo de neoplasia mieloproliferativa caracterizada por la trombocitosis clonal vinculada a mutaciones somáticas que involucran a Janus quinasa 2, calreticulina y el oncogén del virus de la leucemia mieloproliferativa. Los pacientes pueden estar asintomáticos o presentar síntomas vasomotores como cefaleas, eritromelalgia y alteraciones visuales transitorias. La evolución puede complicarse con eventos trombohemorrágicos, así como con la progresión a mielofibrosis y LMA. El diagnóstico se basa en un hallazgo de laboratorio de trombocitosis, biopsia de médula ósea y estudios genéticos. El tratamiento tiene como objetivo reducir el recuento de plaquetas con agentes citorreductores (hidroxiurea) y disminuir la trombosis con aspirina y anticoagulación sistémica según la estratificación del riesgo de trombosis.
Última actualización: May 15, 2022
La trombocitemia esencial es una neoplasia mieloproliferativa crónica caracterizada por una producción excesiva de plaquetas y un aumento de la tendencia trombótica y hemorrágica. Otros nombres son trombocitosis esencial y trombocitosis primaria.
La hematopoyesis comienza con la célula madre hematopoyética, que se incita a dividirse y diferenciarse con estímulos químicos apropiados (factores de crecimiento hematopoyético).
Producción de plaquetas:
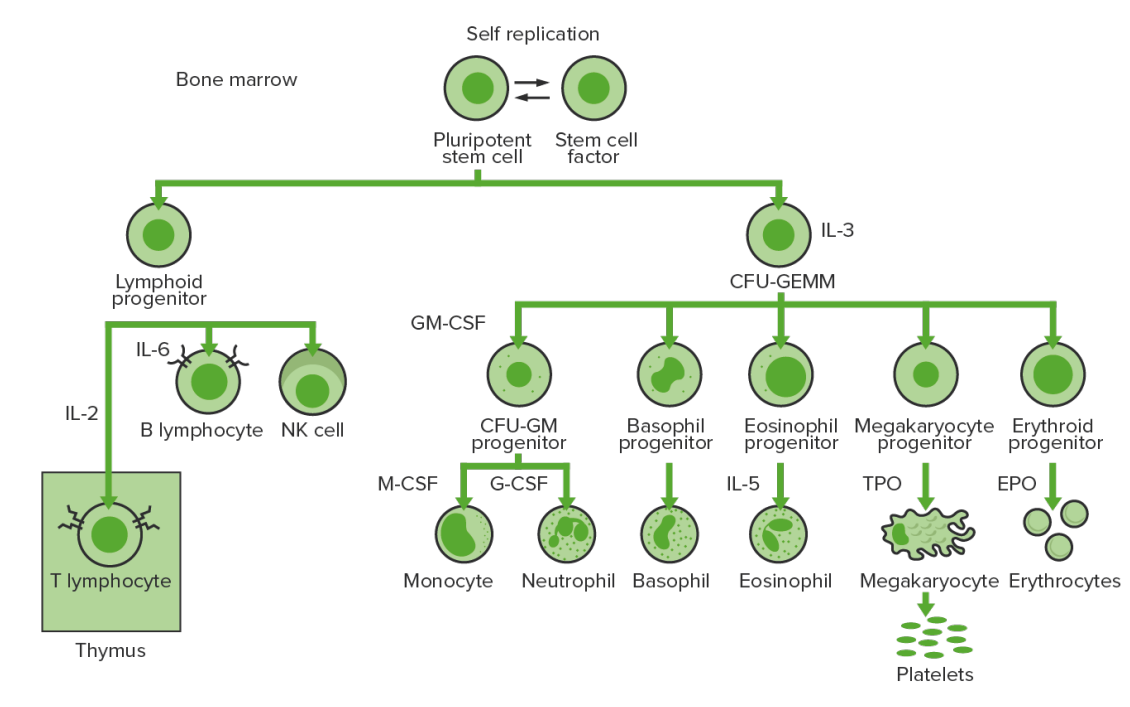
Hematopoyesis de la médula ósea: proliferación y diferenciación de los elementos sólidos de la sangre.
CFU-GEMM: unidad formadora de colonias: granulocitos, eritrocitos, monocitos, megacariocitos
CFU-GM: unidad formadora de colonias-granulocitos-macrófagos
GM-CSF: factor estimulante de colonias de granulocitos y macrófagos
M-CSF: factor estimulante de colonias de macrófagos
G-CSF: factor estimulante de colonias de granulocitos
NK: asesina natural
TPO: trombopoyetina
Mayor incidencia debido a:
El aumento de la diátesis hemorrágica se debe a:
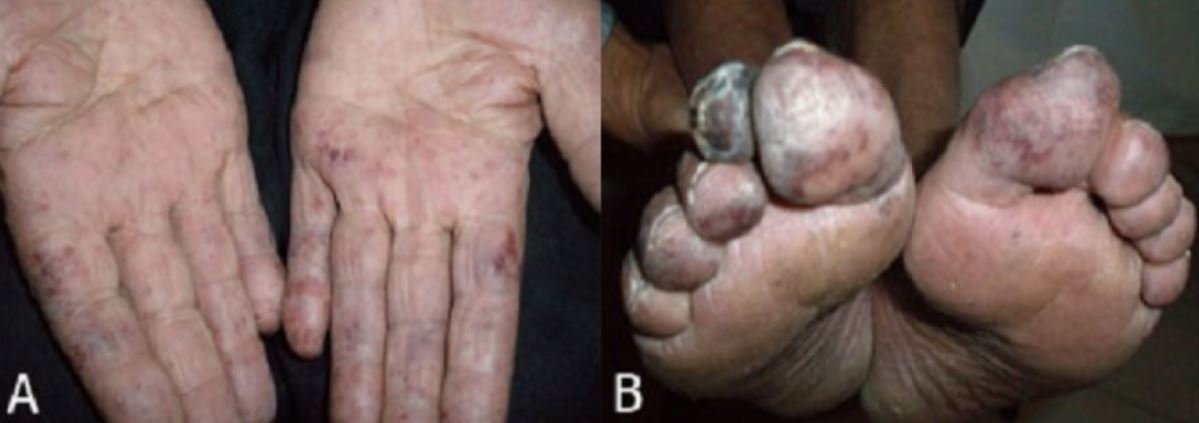
Hallazgos físicos de trombocitemia esencial:
Livedo reticularis y áreas de isquemia azulada moteada de los dedos (A) y gangrena del dedo del pie (B)
El diagnóstico requiere los 4 criterios mayores o los primeros 3 criterios mayores y 1 criterio menor.
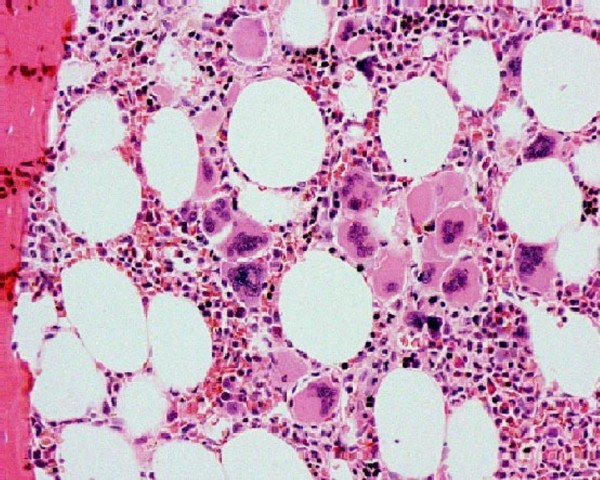
Biopsia de médula ósea en trombocitemia esencial:
Se puede observar un aumento de megacariocitos.
Las neoplasias mieloproliferativas se pueden comparar con la siguiente clasificación de la WHO:
| Enfermedad | Mutaciones | Puntos clave |
|---|---|---|
| LMC | BCR-ABL1 (cromosoma Filadelfia) | Proliferación de granulocitos maduros y en proceso de maduración. |
| Trombocitemia esencial | JAK2, CALR o leucemia mieloproliferativa | Producción clonal excesiva de plaquetas |
| Policitemia vera | JAK2 | Conteo elevado de eritrocitos |
| Mielofibrosis primaria | JAK2, CALR o leucemia mieloproliferativa | Fibrosis obliterante de la médula ósea |
Otros tipos:
| Riesgo de trombosis | Características | Tratamiento |
|---|---|---|
| Muy bajo riesgo |
|
|
| Riesgo bajo |
|
|
| Riesgo intermedio |
|
|
| Alto riesgo |
|
|