Los aminoácidos son los componentes básicos de las proteínas, cuya producción es una cascada enzimática estrechamente regulada. Los trastornos de las enzimas que intervienen en el metabolismo de los aminoácidos son a menudo graves y se presentan en las primeras etapas de la vida. Los errores congénitos del metabolismo de los aminoácidos se deben a una alteración de la síntesis o de la degradación. En los Estados Unidos, los neonatos son examinados rutinariamente al nacer para detectar trastornos comunes del metabolismo de los aminoácidos, que incluyen la fenilcetonuria, enfermedad de la orina con olor a jarabe de arce, homocistinuria, tirosinemia y alcaptonuria. Los síntomas de estas afecciones suelen presentarse en las primeras etapas de la vida. Aunque el tratamiento varía, la mayoría de estas afecciones requieren cambios en la dieta, y algunas requieren suplementos de proteínas u otros regímenes de medicación.
Última actualización: May 6, 2022
La fenilcetonuria es una enfermedad hereditaria que provoca un aumento de los niveles de fenilalanina en el organismo debido a la incapacidad de metabolizar este aminoácido.
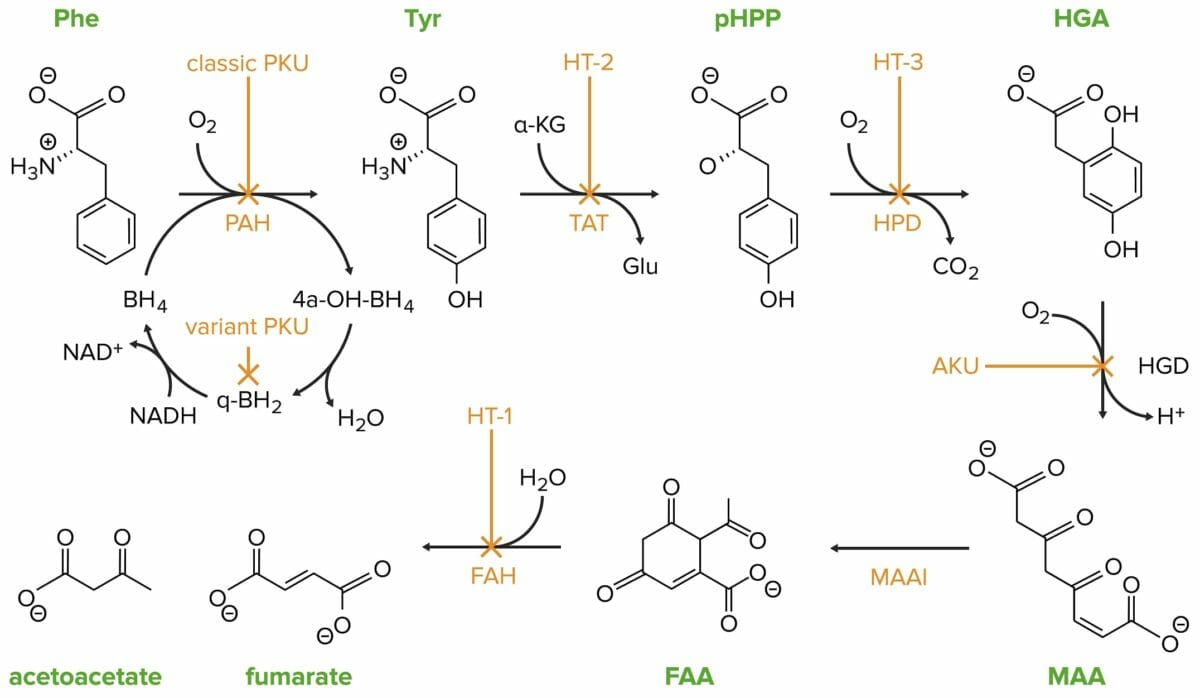
La fenilcetonuria clásica está causada por una mutación en el gen de la fenilalanina hidroxilasa.
Phe: fenilalanina
PAH: fenilalanina hidroxilasa
Tyr: tirosina
HT-2: tirosinemia II
TAT: tirosina transaminasa
pHPP: p-hidroxifenilpiruvato
HPD: p-hidroxifenilpiruvato dioxigenasa
HT-3: tirosinemia III
HGA: homogentisato
HGD: homogentisato oxidasa
AKU: alcaptonuria
MAA: 4-maleilacetoacetato
MAAI: 4-maleilacetoacetato isomerasa
FAA: 4-fumarilacetoacetato
FAH: 4-fumarilacetoacetasa
HT-1: tirosinemia I
Se extrae sangre de un lactante de 2 semanas para realizar un tamizaje de fenilcetonuria.
Imagen: “Phenylketonuria testing” por USAF Photographic Archives. Licencia: Dominio PúblicoEsta afección no puede curarse y debe tratarse con modificaciones en la dieta y medicación/suplementos.
La cistinuria es una causa genética de cálculos renales debido a la afección del transporte renal de cistina. Hay una reabsorción tubular proximal disminuida de la cistina filtrada, resultando en una excreción aumentada de cistina en la orina y en formación de cálculos de cistina.
Sospecha clínica:
Pruebas confirmatorias:
La homocistinuria es un trastorno metabólico heredado del metabolismo de la metionina, que resulta en niveles elevados de homocisteína en el plasma y la orina, y causa un abanico de manifestaciones clínicas.
Hay 2 vías metabólicas normales de la homocisteína:
Las elevaciones en los niveles plasmáticos de homocisteína provienen de:
Otras causas de homocisteína plasmática elevada:
Sospecha clínica:
Pruebas confirmatorias:
Un trastorno genético que se manifiesta en el metabolismo anormal de la tirosina, un aminoácido involucrado en la síntesis de hormonas tiroides, catecolaminas y melanina.
Bajo condiciones no patológicas, la tirosina es metabolizada por los hepatocitos y los túbulos proximales renales en acetoacetato (cetogénico) y fumarato (glucogénico).
Defectos genéticos:
HT1:
HT2:
HT3:
Alcaptonuria:
Sospecha clínica:
Pruebas confirmatorias:
Grupo de trastornos genéticos del metabolismo de los aminoácidos que afectan a los aminoácidos de cadena ramificada, como la leucina, la isoleucina y la valina. Estos trastornos están causados por la alteración del metabolismo de estos aminoácidos, lo que provoca la acumulación de metabolitos tóxicos que a menudo se vierten en la orina.
Existen 4 tipos principales de acidemia orgánica:
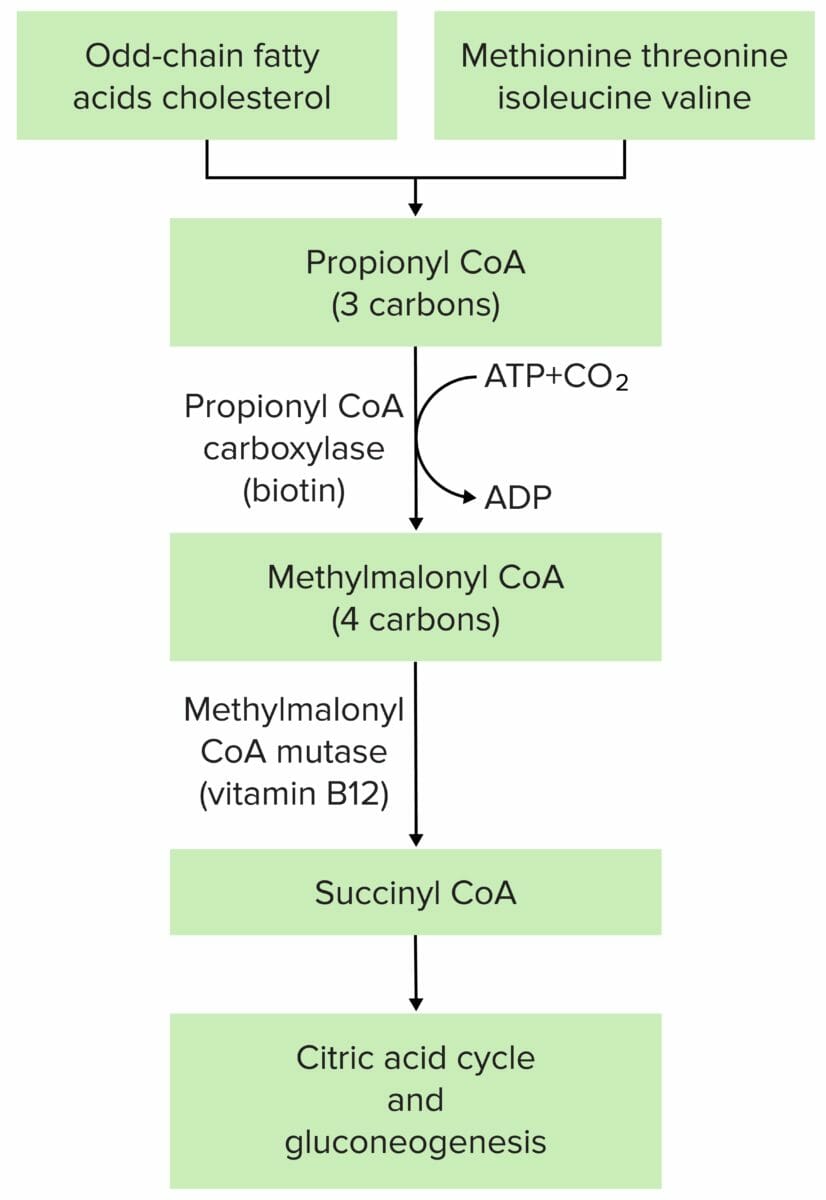
La fisiopatología de la acidemia metilmalónica se debe en la mayoría de los casos a una mutación en la metilmalonil-CoA mutasa o en la metilmalonil-CoA epimerasa.
Imagen por Lecturio.