La terapia dirigida ejerce actividad antineoplásica contra las células cancerosas al interferir con las propiedades únicas que se encuentran en los tumores o malignidades. Los tipos de medicamentos pueden ser moléculas pequeñas, que pueden ingresar a las células, o anticuerpos monoclonales, que tienen sus dianas fuera o sobre la superficie de las células. Entre las áreas de las células malignas que se bloquean o inhiben mediante la terapia dirigida se encuentran las vías de señalización (como se observa en los inhibidores de la proteína cinasa), que conducen a una disminución de la proliferación y la subsiguiente apoptosis de las células tumorales. Otro medio de reducir las células cancerosas es eliminar la capacidad de reparación del ADN (visto en los inhibidores de la poli(ADP-ribosa) polimerasa), bloquear la unión del ligando al receptor (inhibidores del factor de crecimiento) y aumentar la actividad inmunitaria contra la neoplasia (inmunoterapias). Estos agentes se utilizan en múltiples tipos de cáncer y en combinación con agentes quimioterapéuticos tradicionales.
Última actualización: Jun 1, 2022
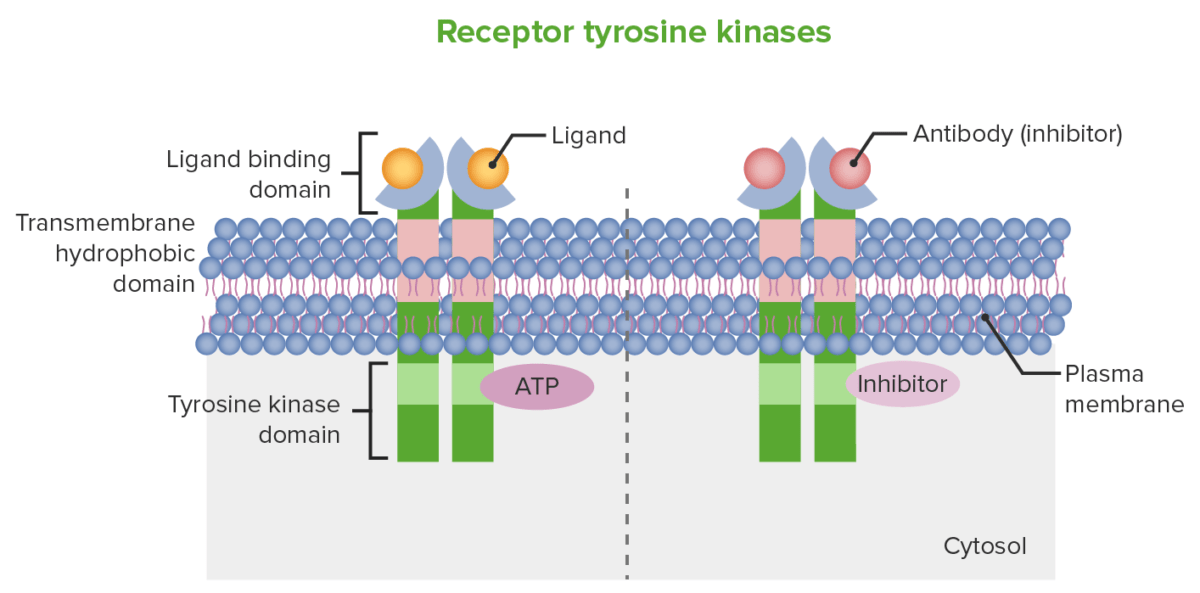
Mecanismo esquemático de la inhibición del receptor tirosina quinasa: A la izquierda, la imagen muestra la estructura del receptor de la célula. En la superficie celular se encuentra el dominio de unión al ligando y el dominio quinasa (en esta imagen, tirosina quinasa) se encuentra intracelularmente. A la derecha, la imagen muestra cómo un anticuerpo monoclonal puede producir actividad antineoplásica, que es a través de la inhibición mediada por anticuerpos del dominio de unión al ligando. Las moléculas pequeñas, que pueden ingresar a las células, pueden producir la inhibición del dominio de unión al ATP (tirosina quinasa).
Imagen por Lecturio.| Imatinib | Dasatinib | Nilotinib | |
|---|---|---|---|
| Farmacodinamia |
|
||
| Farmacocinética |
|
||
| Indicaciones |
|
||
| Efectos secundarios |
|
|
|
| Contraindicaciones |
|
||
| Vemurafenib | Dabrafenib* | |
|---|---|---|
| Farmacodinamia | Inhibir la actividad quinasa de BRAF mutado (incluida la mutación V600) | |
| Farmacocinética |
|
|
| Indicaciones |
|
|
| Efectos secundarios |
|
|
| Contraindicaciones | Hipersensibilidad al medicamento | |
| Trametinib | Cobimetinib | |
|---|---|---|
| Farmacodinamia | Inhibe la activación de MEK y la actividad de la quinasa | |
| Farmacocinética |
|
|
| Indicaciones |
|
Melanoma |
| Efectos secundarios |
|
|
| Contraindicaciones | Hipersensibilidad al medicamento | |
| Ruxolitinib | Barcitinib | |
|---|---|---|
| Farmacodinamia | Inhiben JAK | |
| Farmacocinética |
|
|
| Indicaciones |
|
|
| Efectos secundarios |
|
|
| Contraindicaciones | Hipersensibilidad al medicamento | |
| Palbociclib | Abemaciclib | |
|---|---|---|
| Farmacodinamia | Inhibidor de la CDK; previene la progresión a través del ciclo celular, lo que lleva a la interrupción en la fase G1 | |
| Farmacocinética |
|
|
| Indicaciones | Cáncer de mama avanzado | |
| Efectos secundarios |
|
|
| Contraindicaciones | Hipersensibilidad al medicamento | |
| Ibrutinib | Acalabrutinib | |
|---|---|---|
| Farmacodinamia | Inhibe la BTK, lo que reduce la proliferación de linfocitos B y el crecimiento tumoral | |
| Farmacocinética |
|
|
| Indicaciones |
|
|
| Efectos secundarios |
|
|
| Contraindicaciones | Hipersensibilidad al medicamento | |
| Crizotinib | Alectinib | Ceritinib | |
|---|---|---|---|
| Farmacodinamia | Inhiben ALK, previniendo la proliferación y supervivencia de tumores ALK positivos | ||
| Farmacocinética |
|
|
|
| Indicaciones |
|
||
| Efectos secundarios |
|
||
| Contraindicaciones | Hipersensibilidad al medicamento | ||
| Cetuximab | Panitumumab | |
|---|---|---|
| Farmacodinamia |
|
|
| Farmacocinética |
|
|
| Indicaciones |
|
|
| Efectos secundarios |
|
|
| Contraindicaciones | Hipersensibilidad al medicamento o a sus componentes | |
| Afatinib | Erlotinib | Gefitinib | |
|---|---|---|---|
| Farmacodinamia | Inhibidor de la tirosina quinasa del EGFR | ||
| Farmacocinética |
|
|
|
| Indicaciones | Cáncer de pulmón de células no pequeñas (con mutaciones) |
|
Cáncer de pulmón de células no pequeñas (con mutaciones del EGFR) |
| Efectos secundarios |
|
||
| Contraindicaciones | Hipersensibilidad al medicamento o sus componentes | ||
| Bevacizumab | Ziv-aflibercept | Sorafenib | |
|---|---|---|---|
| Farmacodinamia | Anticuerpo monoclonal dirigido al ligando VEGF | Proteína de fusión recombinante que actúa como receptor señuelo | Inhibe las tirosina quinasas del VEGFR (y también al PDGF) |
| Farmacocinética |
|
|
|
| Indicaciones |
|
Cáncer colorrectal metastásico |
|
| Efectos secundarios |
|
||
| Contraindicaciones |
|
Ninguno listado |
|
| Trastuzumab | Pertuzumab | lapatinib | |
|---|---|---|---|
| Farmacodinamia | Anticuerpo monoclonal que se une a HER2 (dominio extracelular) | Inhibidor dual de quinasa (inhibe EGFR y HER2) | |
| Farmacocinética |
|
|
|
| Indicaciones |
|
Cáncer de mama | Cáncer de mama |
| Efectos secundarios |
|
|
|
| Contraindicaciones | Hipersensibilidad al medicamento | ||
| Olaparib | Rucaparib | Niraparib | |
|---|---|---|---|
| Farmacodinamia | Inhibidor de la enzima PARP | ||
| Farmacocinética |
|
|
|
| Indicaciones |
|
|
Cáncer de ovario, trompa de Falopio o peritoneal primario |
| Efectos secundarios comunes |
|
||
| Efectos secundarios |
|
|
|
| Contraindicaciones | Hipersensibilidad al medicamento | Ninguno listado | Hipersensibilidad al medicamento |
| Medicamentos | Actividad |
|---|---|
Inhibidores de la proteína quinasa:
|
Inhiben la acción de las enzimas proteína quinasa |
Inhibidores del receptor del factor de crecimiento:
|
|
| Inhibidores de PARP | ↓ Capacidad de reparación del ADN |
| Inhibidores de BCL2 | Promueven la apoptosis de las células cancerosas (que dependen de esta vía) |
| Inhibidores de CD20 | Se unen al antígeno de la superficie celular e inician la lisis de los linfocitos B |
| Inhibidores de la vía Hedgehog | Se unen al componente proteico e inhiben la transducción de señales de Hedgehog, ↓ proliferación de células (en carcinoma de células basales) |
| Inhibidores de puntos de control inmunitario | Inhiben puntos de control inmunitario (CTLA4, PD-1), lo que permite la activación y proliferación de linfocitos T |
| Inhibidores de mTOR | Inhiben la actividad de la quinasa mTOR, lo que reduce la síntesis de proteínas, la proliferación celular y la angiogénesis |
| Inhibidores del proteasoma | Bloquean la actividad del proteasoma, interrumpiendo la señalización y aumentando la apoptosis celular |
| Asparaginasa | Reduce la asparagina, lo que reduce la fuente de células leucémicas |
| Talidomida |
|