La inmunidad a los LOS Neisseria patógenos se divide en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum respuestas inmunitarias innatas y adaptativas. La respuesta inmune innata es la 1ra línea de defensa contra una variedad de patógenos, incluyendo bacterias, hongos, virus Virus Viruses are infectious, obligate intracellular parasites composed of a nucleic acid core surrounded by a protein capsid. Viruses can be either naked (non-enveloped) or enveloped. The classification of viruses is complex and based on many factors, including type and structure of the nucleoid and capsid, the presence of an envelope, the replication cycle, and the host range. Virology y parásitos. Esencialmente de la misma forma, el tipo innato de inmunidad está presente en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum todos los LOS Neisseria organismos multicelulares. La respuesta inmunitaria innata se activa de minutos a horas después de la exposición a una infección, lo que reduce la invasión de microbios en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum las etapas iniciales. El patógeno tiene componentes específicos reconocidos por receptores de reconocimiento de patrones. Después de la identificación de una invasión microbiana, los LOS Neisseria componentes no celulares (incluido el sistema del complemento y las citoquinas) actúan en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum conjunto con los LOS Neisseria elementos celulares para lograr el reclutamiento celular, la destrucción microbiana directa o la inducción de fagocitosis. Todos los LOS Neisseria pasos apuntan a eliminar el patógeno. Los LOS Neisseria mecanismos antimicrobianos en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum la fagocitosis incluyen la acidificación y el estallido respiratorio/oxidativo. El proceso termina con la destrucción de la amenaza mientras se mantiene la homeostasis Homeostasis The processes whereby the internal environment of an organism tends to remain balanced and stable. Cell Injury and Death inmunológica. La defensa también es importante en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum la activación del sistema inmunológico adaptativo.
Last updated: Dec 15, 2025
El sistema inmunitario brinda defensa (inmunidad) contra patógenos invasores que van desde virus Virus Viruses are infectious, obligate intracellular parasites composed of a nucleic acid core surrounded by a protein capsid. Viruses can be either naked (non-enveloped) or enveloped. The classification of viruses is complex and based on many factors, including type and structure of the nucleoid and capsid, the presence of an envelope, the replication cycle, and the host range. Virology hasta parásitos; Los LOS Neisseria componentes están interconectados por la circulación sanguínea y linfática.
Dos líneas de defensa superpuestas:
| Inmunidad innata | Inmunidad adaptativa | |
|---|---|---|
| Genética | Línea germinal codificada | Reordenamientos genéticos implicados en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum el desarrollo de linfocitos |
| Respuesta inmune | No específica | Altamente específica |
| Tiempo de respuesta | Inmediato (minutos a horas) | Se desarrolla durante un período de tiempo más largo |
| Respuesta de memoria | Ninguna | Responde rápidamente al AL Amyloidosis reconocimiento del antígeno con respuesta de memoria |
| Reconocimiento del patógeno | Los LOS Neisseria receptores de reconocimiento de patrones, como los LOS Neisseria receptores tipo toll, reconocen patrones moleculares asociados a patógenos |
|
| Componentes |
|
|
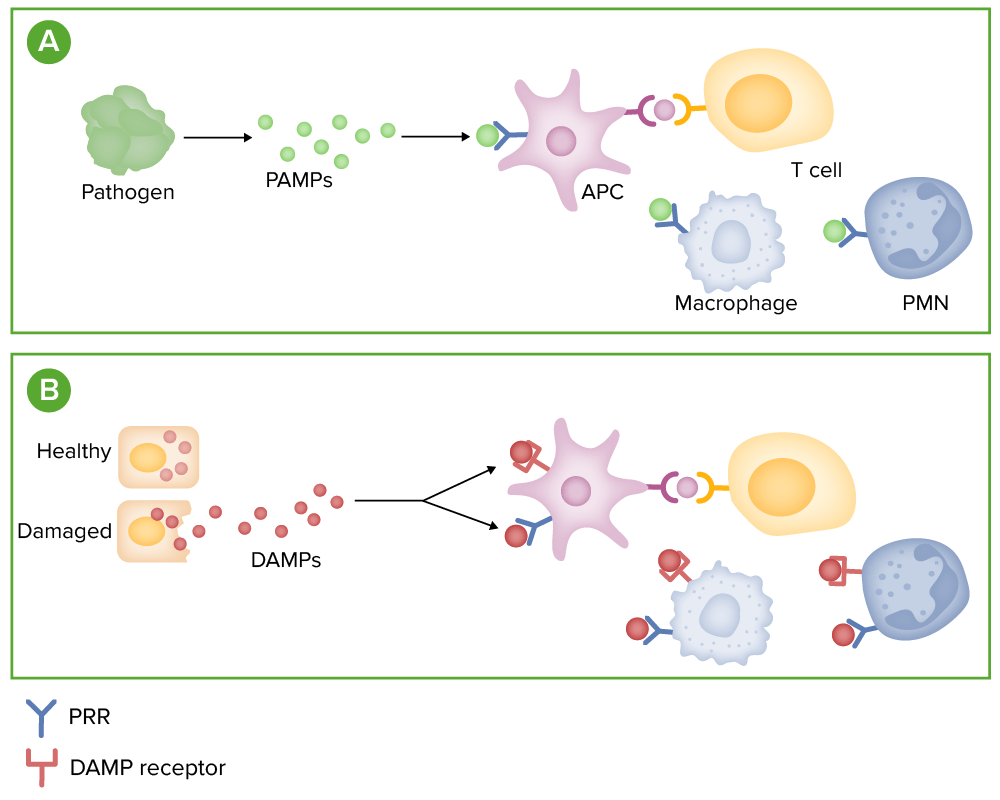
Detección de microbios:
(A) Los microbios liberan patrones moleculares asociados a patógenos (PAMP), que pueden unirse a los receptores de reconocimiento de patrones (PRR), como los receptores tipo Toll, en las células inmunitarias.
(B) Las células estresadas o dañadas liberan moléculas, denominadas patrones moleculares asociados a daños (DAMP). Estas moléculas se unen tanto a los PRR como a los receptores DAMP especializados de las células inmunitarias.
La unión de estos receptores promueve la liberación de mediadores inflamatorios, como citoquinas, quimiocinas y complemento.
PMN: polimorfonuclear (neutrófilo)
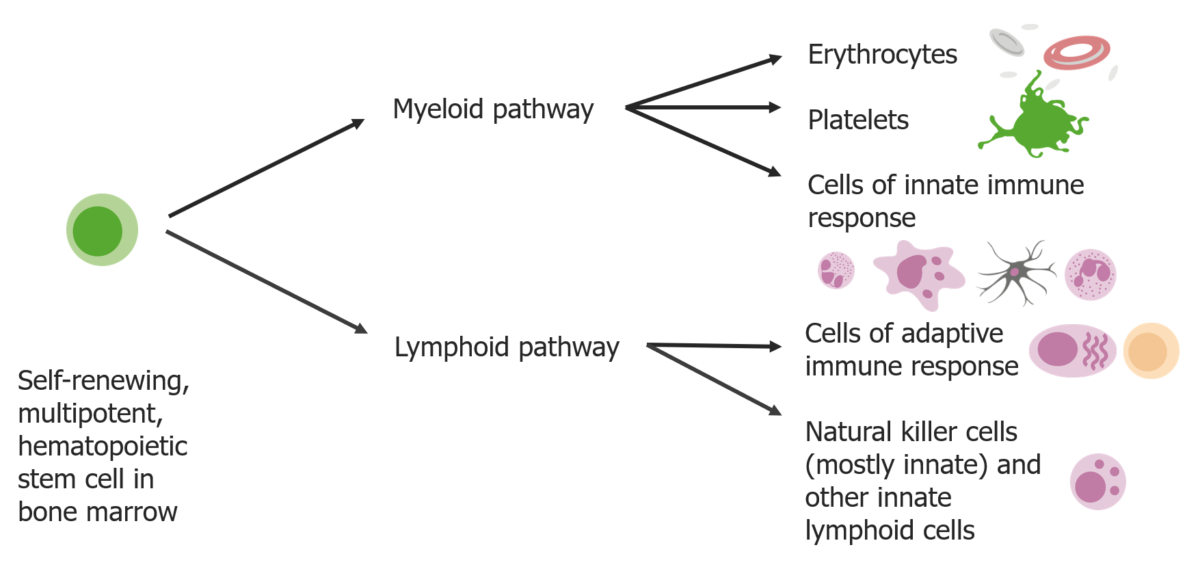
Las células madre se diferencian en 2 vías:
Las vías mieloides producen eritrocitos, plaquetas y células de la respuesta inmune innata. Las vías linfoides producen las células de respuesta adaptativa y las células asesinas naturales.
Las células epiteliales recubren las superficies corporales y están muy expuestas a los LOS Neisseria antígenos.
Incluye:
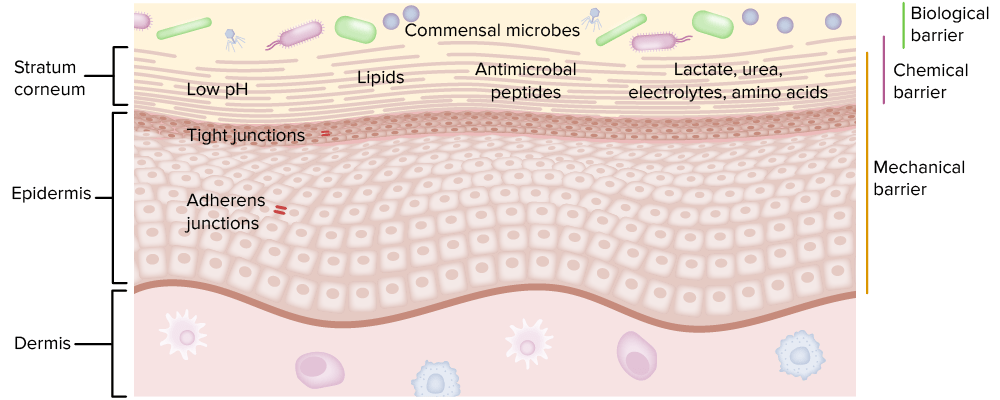
Los 3 tipos diferentes de barreras son una parte importante de la inmunidad innata.
Imagen por Lecturio.Los LOS Neisseria receptores de reconocimiento de patrones asociados a células se expresan en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum diversas células inmunitarias y pueden ser intracelulares (endolisosomal/citoplasmático) o transmembrana.
| Receptor Receptor Receptors are proteins located either on the surface of or within a cell that can bind to signaling molecules known as ligands (e.g., hormones) and cause some type of response within the cell. Receptors tipo toll | Localización | Ligando | Origen del ligando |
|---|---|---|---|
| TLR1 | Membrana plasmática | Triacil lipoproteína | Bacterias |
| TLR2 | Lipoproteína | Bacterias, virus Virus Viruses are infectious, obligate intracellular parasites composed of a nucleic acid core surrounded by a protein capsid. Viruses can be either naked (non-enveloped) or enveloped. The classification of viruses is complex and based on many factors, including type and structure of the nucleoid and capsid, the presence of an envelope, the replication cycle, and the host range. Virology, parásitos | |
| TLR3 | Endolisosoma | ARNds | Virus Virus Viruses are infectious, obligate intracellular parasites composed of a nucleic acid core surrounded by a protein capsid. Viruses can be either naked (non-enveloped) or enveloped. The classification of viruses is complex and based on many factors, including type and structure of the nucleoid and capsid, the presence of an envelope, the replication cycle, and the host range. Virology |
| TLR4 | Membrana plasmática | LPS | Bacterias, virus Virus Viruses are infectious, obligate intracellular parasites composed of a nucleic acid core surrounded by a protein capsid. Viruses can be either naked (non-enveloped) or enveloped. The classification of viruses is complex and based on many factors, including type and structure of the nucleoid and capsid, the presence of an envelope, the replication cycle, and the host range. Virology |
| TLR5 | Flagelina | Bacterias | |
| TLR6 | Lipoproteína de diacil | Bacterias, virus Virus Viruses are infectious, obligate intracellular parasites composed of a nucleic acid core surrounded by a protein capsid. Viruses can be either naked (non-enveloped) or enveloped. The classification of viruses is complex and based on many factors, including type and structure of the nucleoid and capsid, the presence of an envelope, the replication cycle, and the host range. Virology | |
| TLR7, TLR8 | Endolisosoma | ARNss | Virus Virus Viruses are infectious, obligate intracellular parasites composed of a nucleic acid core surrounded by a protein capsid. Viruses can be either naked (non-enveloped) or enveloped. The classification of viruses is complex and based on many factors, including type and structure of the nucleoid and capsid, the presence of an envelope, the replication cycle, and the host range. Virology, bacterias |
| TLR9 | CpG-ADN | Virus Virus Viruses are infectious, obligate intracellular parasites composed of a nucleic acid core surrounded by a protein capsid. Viruses can be either naked (non-enveloped) or enveloped. The classification of viruses is complex and based on many factors, including type and structure of the nucleoid and capsid, the presence of an envelope, the replication cycle, and the host range. Virology, bacterias, protozoos | |
| TLR10 | Desconocido | Virus Virus Viruses are infectious, obligate intracellular parasites composed of a nucleic acid core surrounded by a protein capsid. Viruses can be either naked (non-enveloped) or enveloped. The classification of viruses is complex and based on many factors, including type and structure of the nucleoid and capsid, the presence of an envelope, the replication cycle, and the host range. Virology de la influenza Influenza Influenza viruses are members of the Orthomyxoviridae family and the causative organisms of influenza, a highly contagious febrile respiratory disease. There are 3 primary influenza viruses (A, B, and C) and various subtypes, which are classified based on their virulent surface antigens, hemagglutinin (HA) and neuraminidase (NA). Influenza typically presents with a fever, myalgia, headache, and symptoms of an upper respiratory infection. Influenza Viruses/Influenza, Listeria Listeria Listeria spp. are motile, flagellated, gram-positive, facultative intracellular bacilli. The major pathogenic species is Listeria monocytogenes. Listeria are part of the normal gastrointestinal flora of domestic mammals and poultry and are transmitted to humans through the ingestion of contaminated food, especially unpasteurized dairy products. Listeria Monocytogenes/Listeriosis monocytogenes |
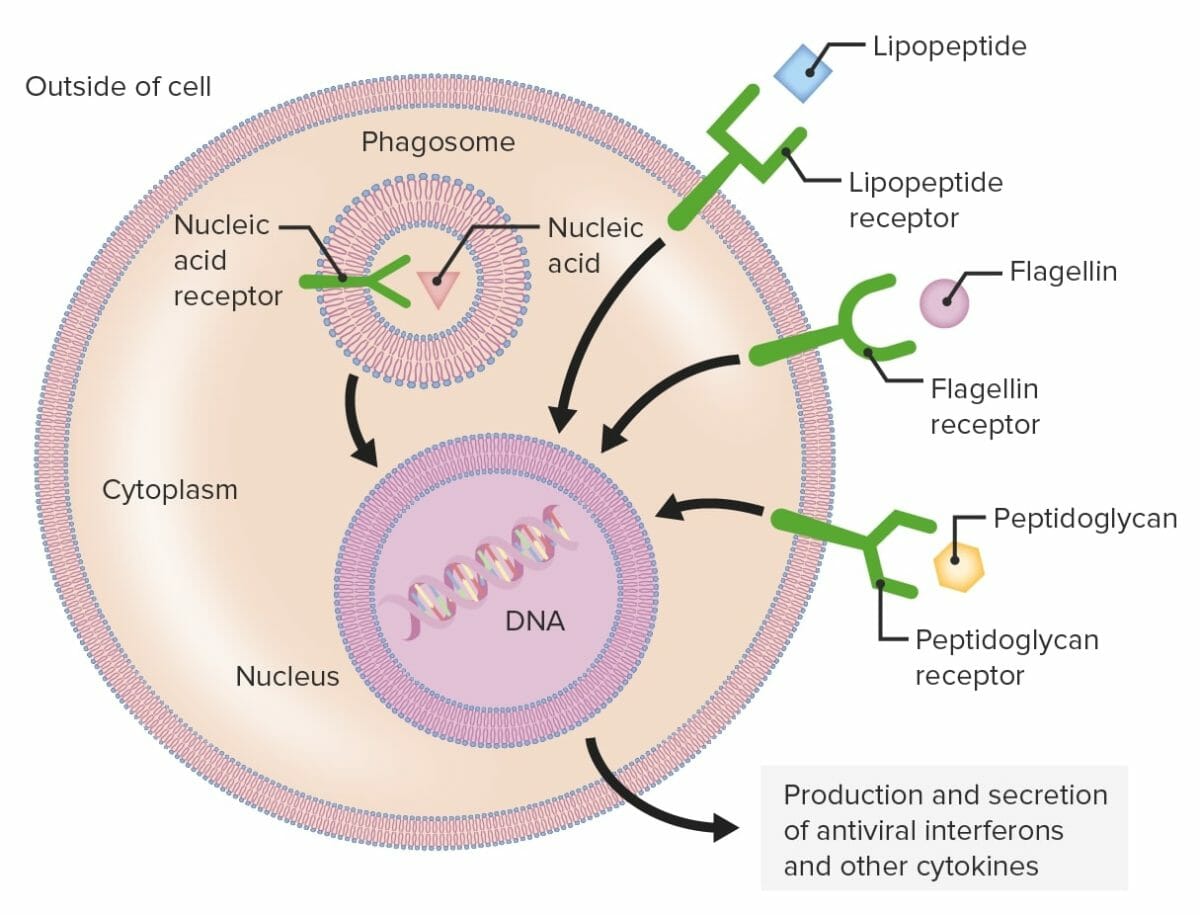
Receptores de reconocimiento de patrones:
Las células fagocíticas contienen receptores de reconocimiento de patrones capaces de reconocer varios patrones moleculares asociados a patógenos. Los receptores tipo Toll (mostrados como estructuras verdes), que son un grupo de receptores de reconocimiento de patrones, reconocen diferentes componentes microbianos, incluidos lipopéptidos, flagelina o peptidoglicano. Los receptores de reconocimiento de patrones se pueden encontrar en la membrana plasmática o intracelularmente.
Cuando un receptor de reconocimiento de patrones reconoce un patrón molecular asociado a patógenos, se envía una señal al núcleo que activa los genes implicados en la fagocitosis, proliferación celular, destrucción intracelular mejorada y la producción y secreción de interferones antivirales y citoquinas proinflamatorias.
Los LOS Neisseria receptores de reconocimiento de patrones secretados y circulantes incluyen muchas proteínas (e.g., péptidos antimicrobianos, lectinas, colectinas).
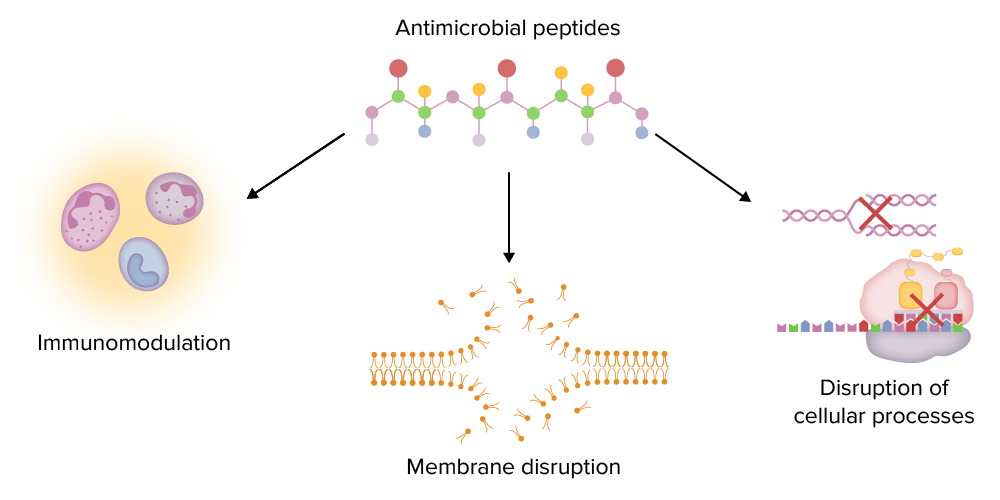
Principales funciones de los péptidos antimicrobianos (AMP):
Los AMPs pueden modular el sistema inmunitario (por ejemplo, estimulando la quimiotaxis, regulando la producción de citoquinas), alterar las membranas microbianas e interrumpir importantes procesos intracelulares (e.g., la síntesis de ADN y proteínas).
Las respuestas inmunitarias siguen al AL Amyloidosis reconocimiento de moléculas patógenas. El sistema del complemento es 1 respuesta activada en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum forma de cascada para destruir los LOS Neisseria microbios.
La activación del complemento se realiza a través de vías distintivas (todas comienzan con una molécula iniciadora diferente), pero todas producen C3b (la molécula central de la cascada del complemento):
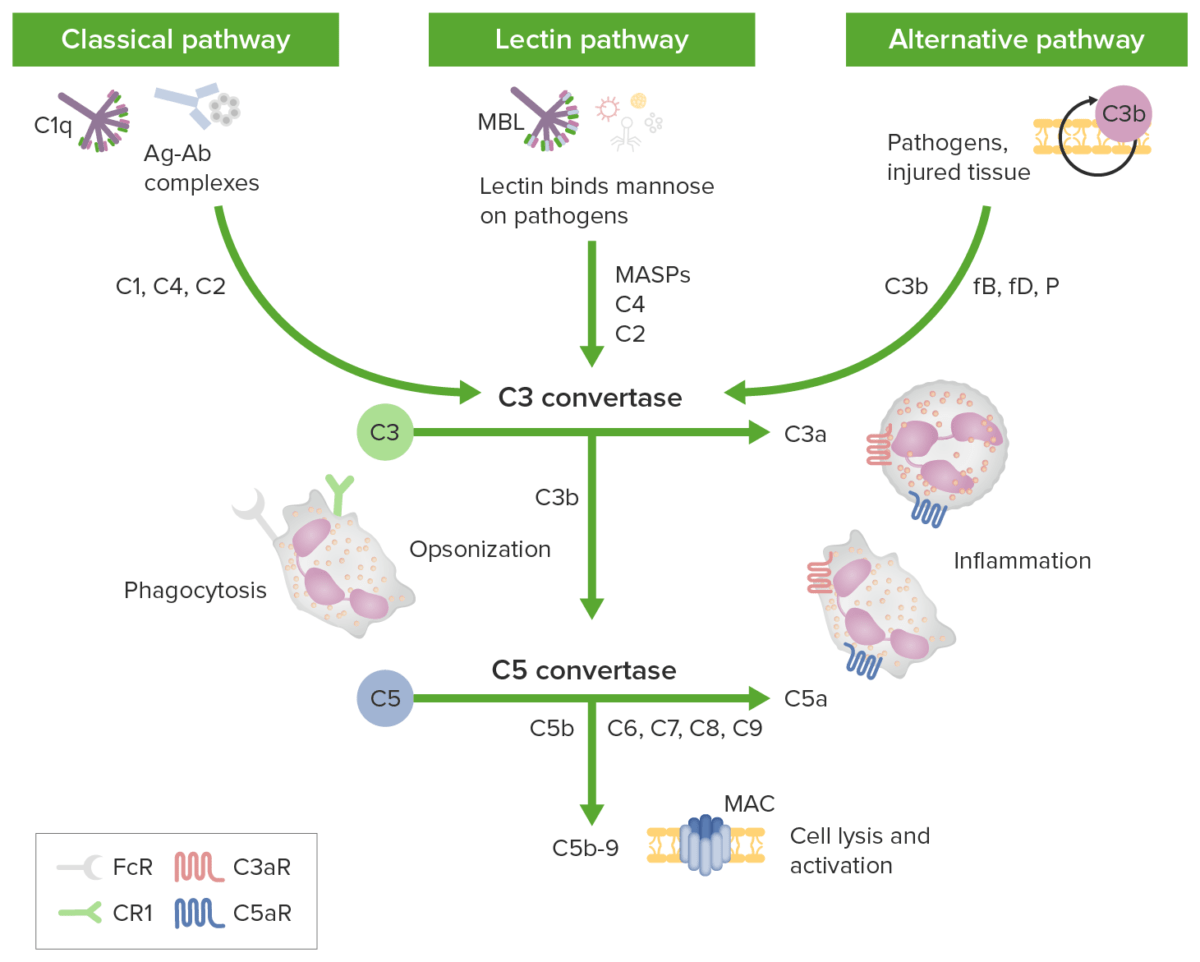
Las vías de iniciación del complemento conducen a una vía terminal común: Los recuadros verdes identifican las vías de iniciación; los componentes del complemento se identifican a lo largo de las flechas. La vía clásica es activada por complejos antígeno-anticuerpo (complejos Ag-Ab) reconocidos por C1q en complejo con C1r y C1s. Las proteasas C1r y C1s escinden C4 y C2 para generar la vía clásica C3 convertasa C4b2b. La vía de la lectina se activa por la unión de la lectina de unión a manosa (MBL) o las ficolinas a los carbohidratos en la membrana diana. Las serina proteasas asociadas a MBL (MASP) luego escinden C4 y C2 generando la convertasa C3 C4b2b. La vía alternativa se activa cuando los niveles bajos de proteína C3b se unen directamente a un microbio, material extraño o tejido dañado. Cuando C3b se une con el factor B, se forma C3bB. El factor B es escindido por el factor D para formar una vía alternativa C3-convertasa (C3bBb). La convertasa es estabilizada por la properdina. C3b opsoniza objetivos para fagocitosis y activación de células B. Las 3 vías de iniciación convergen en C3 con distintas convertasas C3 que escinden C3 para generar anafilatoxina C3a y más C3b para formar las convertasas C5 (C4b2a3b y C3bBb3b). La convertasa C5 luego escinde C5 en C5a y C5b. Las anafilatoxinas C3a, C4a y C5a pueden atraer/activar células inflamatorias y contraer el músculo liso a través de los receptores C3aR y C5aR. El complejo de ataque a membrana (MAC) se forma cuando C5b se une a C6, C7, C8 y múltiples copias de C9. Los poros complejos de ataque a membrana pueden causar la muerte celular por flujo osmótico.
Imagen por Lecturio.En EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum última instancia, las vías del complemento tienen como objetivo eliminar los LOS Neisseria microbios y los LOS Neisseria desechos celulares/células apoptóticas:
Las citoquinas son proteínas solubles liberadas por diferentes células, que desempeñan funciones superpuestas en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum la inmunidad innata y adaptativa, como el sistema del complemento.
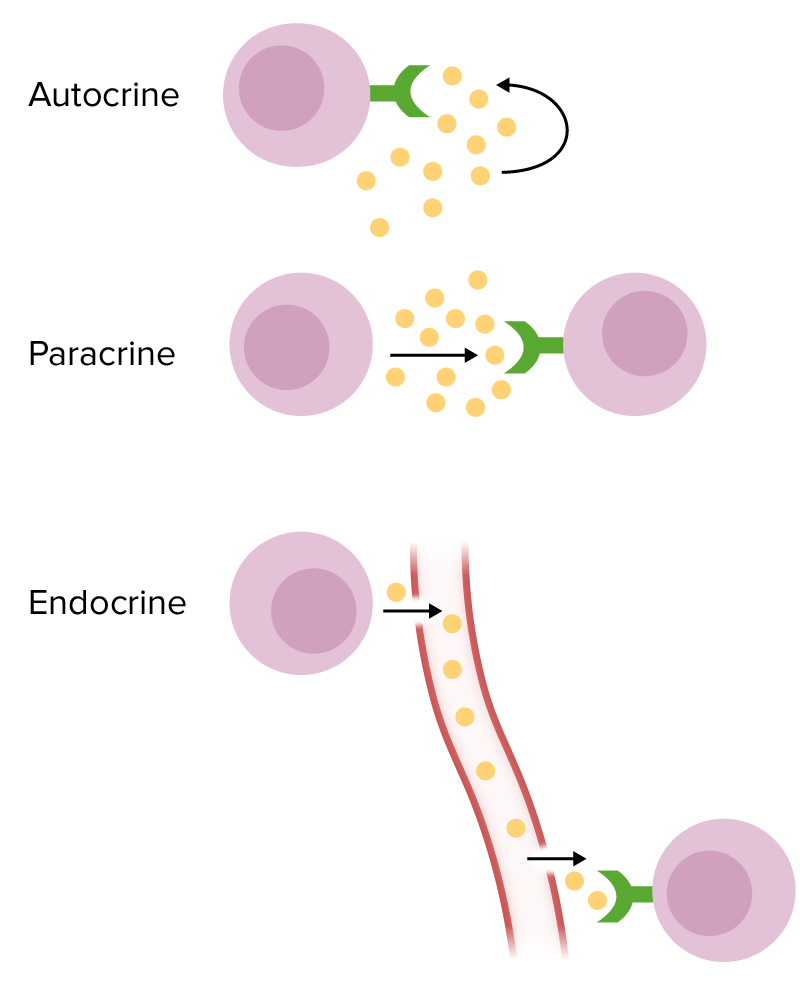
Formas de señalización química:
Autocrina: La célula diana es la misma que segrega citoquinas.
Paracrina: La célula diana de las citoquinas es una célula cercana.
Endocrina: Las citoquinas se secretan en la circulación para llegar a una célula diana lejana.
| Citoquinas | Fuente | Función y actividad |
|---|---|---|
| IL-1 | Monocitos, macrófagos, células B, fibroblastos, la mayoría de las células epiteliales |
|
| IL-2 | Células T |
|
| IL-3 | Células T, células NK, mastocitos | Estimulación de progenitores de hematopoyesis |
| IL-4 | Células T, mastocitos, basófilos |
|
| IL-5 | Células T, mastocitos, eosinófilos |
|
| IL-6 | Monocitos, macrófagos, células B, fibroblastos, la mayoría de las células epiteliales |
|
| IL-7 IL-7 A proinflammatory cytokine produced primarily by T-lymphocytes or their precursors. Several subtypes of interleukin-17 have been identified, each of which is a product of a unique gene. Severe Combined Immunodeficiency (SCID) | Médula ósea, células epiteliales del timo | Diferenciación de células B, células T y células NK |
| IL-8 | Monocitos, macrófagos, células T, neutrófilos, fibroblastos, células endoteliales, células epiteliales |
|
| IL-9 | Células T |
|
| IL-10 | Monocitos, macrófagos, células T, células B, queratinocitos, mastocitos |
|
| IL-11 | Células del estroma de la médula ósea |
|
| IL-12 | Macrófagos activados, células dendríticas, neutrófilos |
|
| IFN-ɣ | Células T, células NK |
|
| TNF-ɑ | Monocitos, macrófagos, mastocitos, basófilos, eosinófilos, células NK, células B, células T, fibroblastos, células epiteliales tímicas |
|
| Factor de crecimiento transformador-β | La mayoría de las células | Antiinflamatorio |
Después del reconocimiento de patógenos y el reclutamiento de células inmunitarias (con la ayuda coordinada de complementos y citoquinas), se implementan estrategias para eliminar los LOS Neisseria microbios.
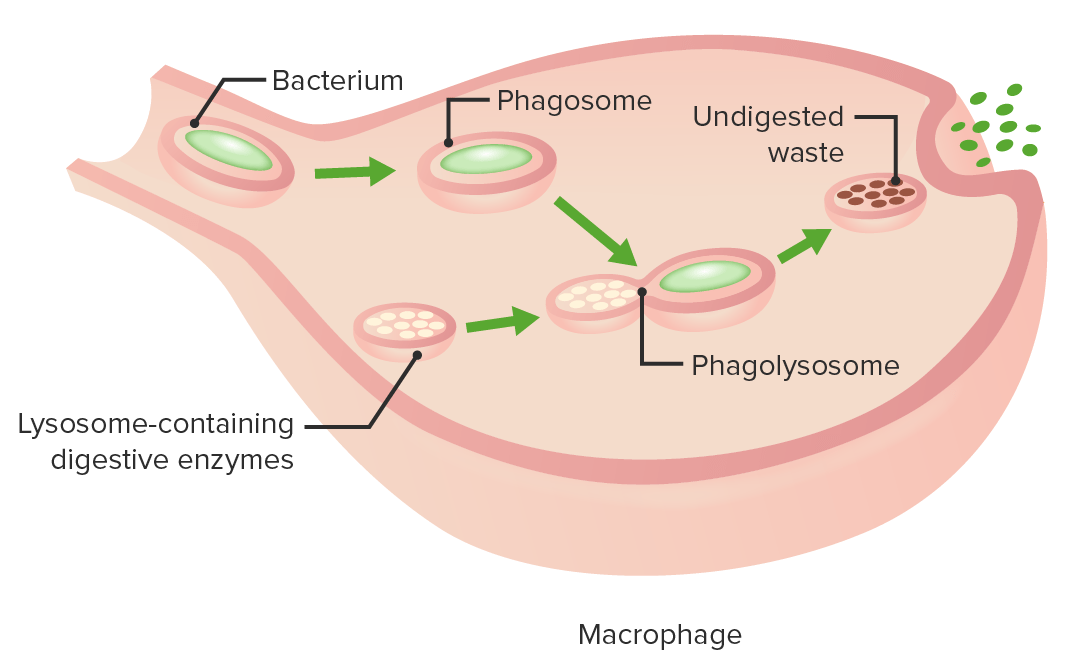
Las etapas de la fagocitosis:
Inmersión de un patógeno, formación de un fagosoma, digestión de la partícula patógena en el fagolisosoma, expulsión de materiales no digeridos de la célula
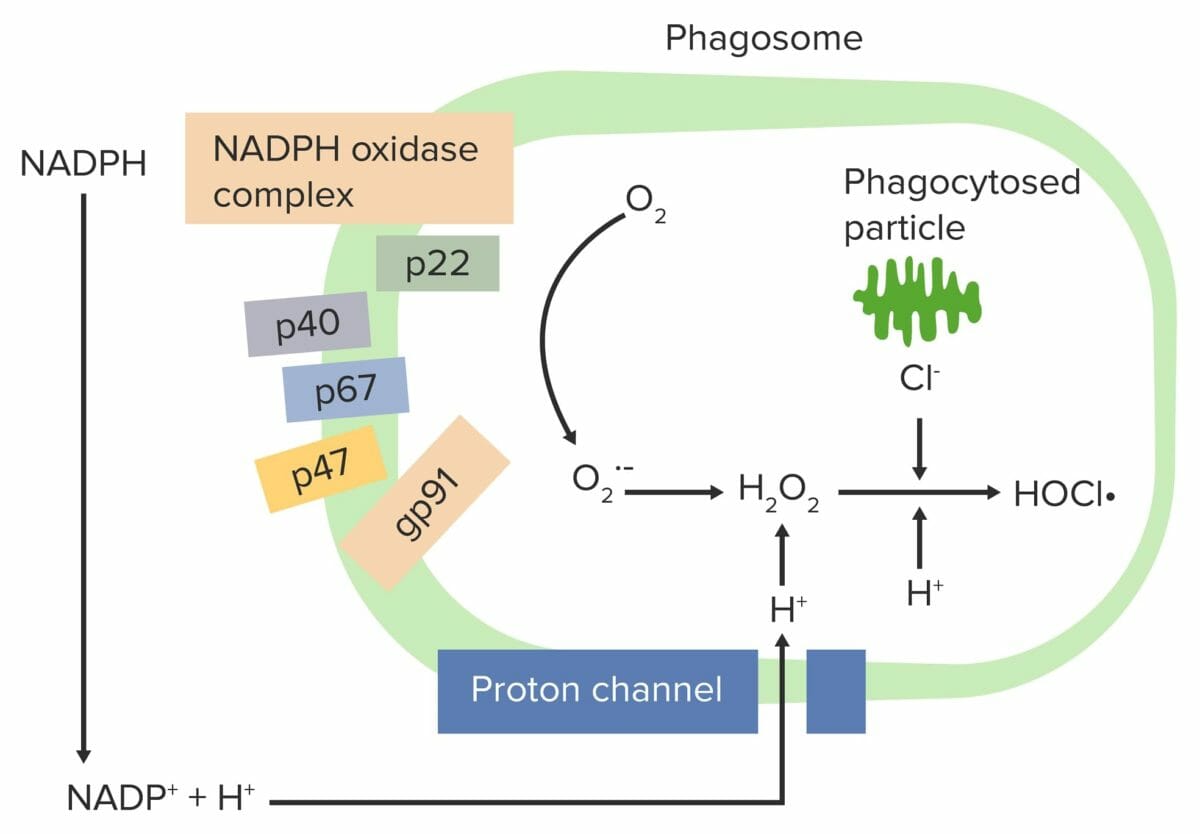
Estallido respiratorio iniciado por el complejo NADPH-oxidasa:
El complejo fagocitario NADPH-oxidasa se activa, reduciendo el O2 a un radical libre de oxígeno (anión superóxido (O2•–)) y luego a H2O2. Los neutrófilos y los monocitos (usando mieloperoxidasa) combinan H2O2 con Cl– para producir hipoclorito (HOCl•), que ayuda a destruir las bacterias.