La mielofibrosis primaria (MFP) es una neoplasia mieloproliferativa caracterizada por mieloproliferación crónica con depósito fibroblástico no clonal, lo que resulta en fibrosis de la médula ósea. La anomalía proviene de mutaciones genéticas de las células madre hematopoyéticas (típicamente, mutación JAK2). Los síntomas primarios son anemia y hematopoyesis extramedular, que incluyen fatiga severa, pérdida de peso y hepatoesplenomegalia. Los hallazgos de laboratorio incluyen anemia (y otras citopenias), y la biopsia de médula ósea revela fibrosis extensa. El tratamiento es con trasplante de células madre hematopoyéticas e intervenciones dirigidas a los síntomas.
Última actualización: May 10, 2022
La mielofibrosis primaria (MFP) es una neoplasia mieloproliferativa crónica caracterizada por la proliferación de células mieloides, con proliferación de fibroblastos no clonales e hiperactividad, lo que resulta en una fibrosis medular obliterante. Otros nombres incluyen mielofibrosis idiopática crónica y metaplasia mieloide agnogénica.
La hematopoyesis comienza con la célula madre hematopoyética, quien es incitada a dividirse y diferenciarse por estímulos químicos apropiados (factores de crecimiento hematopoyético)
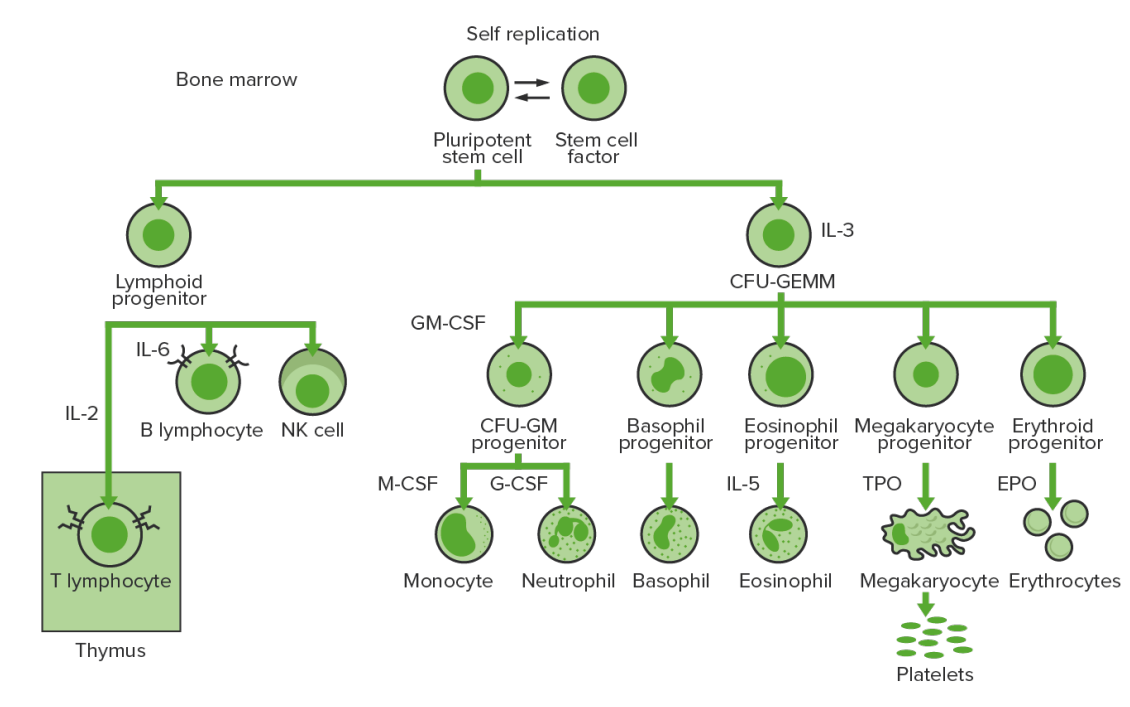
Hematopoyesis de la médula ósea: proliferación y diferenciación de los elementos formes de la sangre.
CFU-GEMM: unidad formadora de colonias de granulocitos, eritrocitos, monocitos y megacariocitos
CFU-GM: unidad formadora de colonias de granulocitos y macrófagos
GM-CSF: factor estimulante de colonias de granulocitos y macrófagos
M-CSF: factor estimulante de colonias de macrófagos
G-CSF: factor estimulante de colonias de granulocitos
NK: asesina natural
TPO: trombopoyetina
Las mutaciones en los genes asociados con la hematopoyesis se observan en una proporción significativa de casos de MFP.
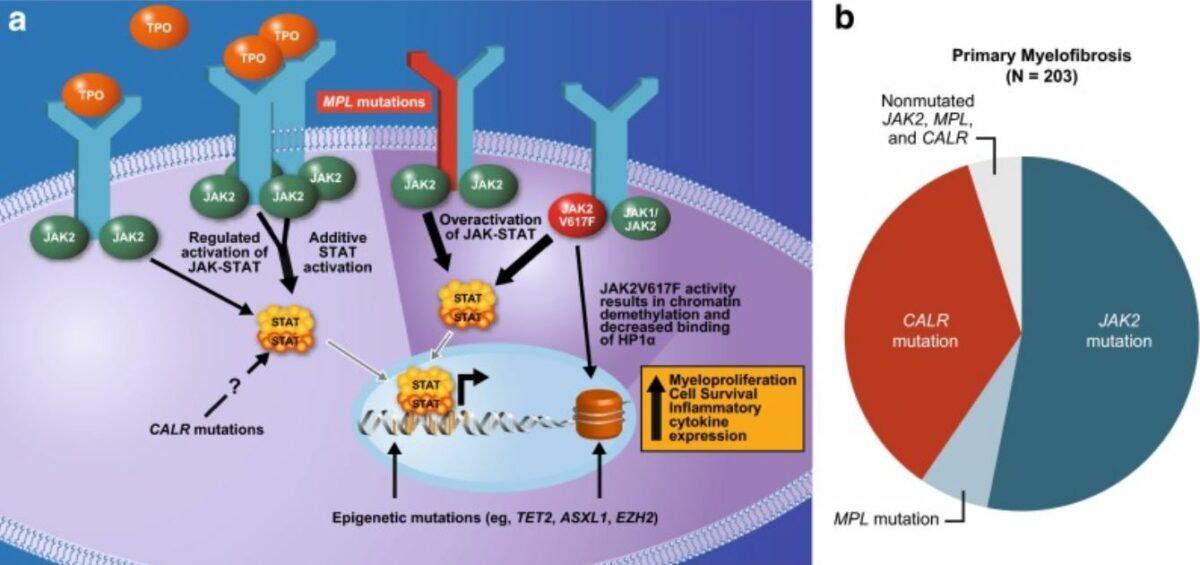
Mutaciones subyacentes a la fisiopatología de la mielofibrosis:
Comúnmente afecta la vía JAK-STAT
JAK2 (gen JAK2 implicado): tirosina quinasa no receptora que facilita que las señales extracelulares lleguen al núcleo y activen los genes.
MPL o receptor de trombopoyetina (gen MPL implicado): activación del receptor de trombopoyetina
La calreticulina (gen CALR implicado) es un regulador de STAT, y la mutación provoca la activación del receptor de trombopoyetina.
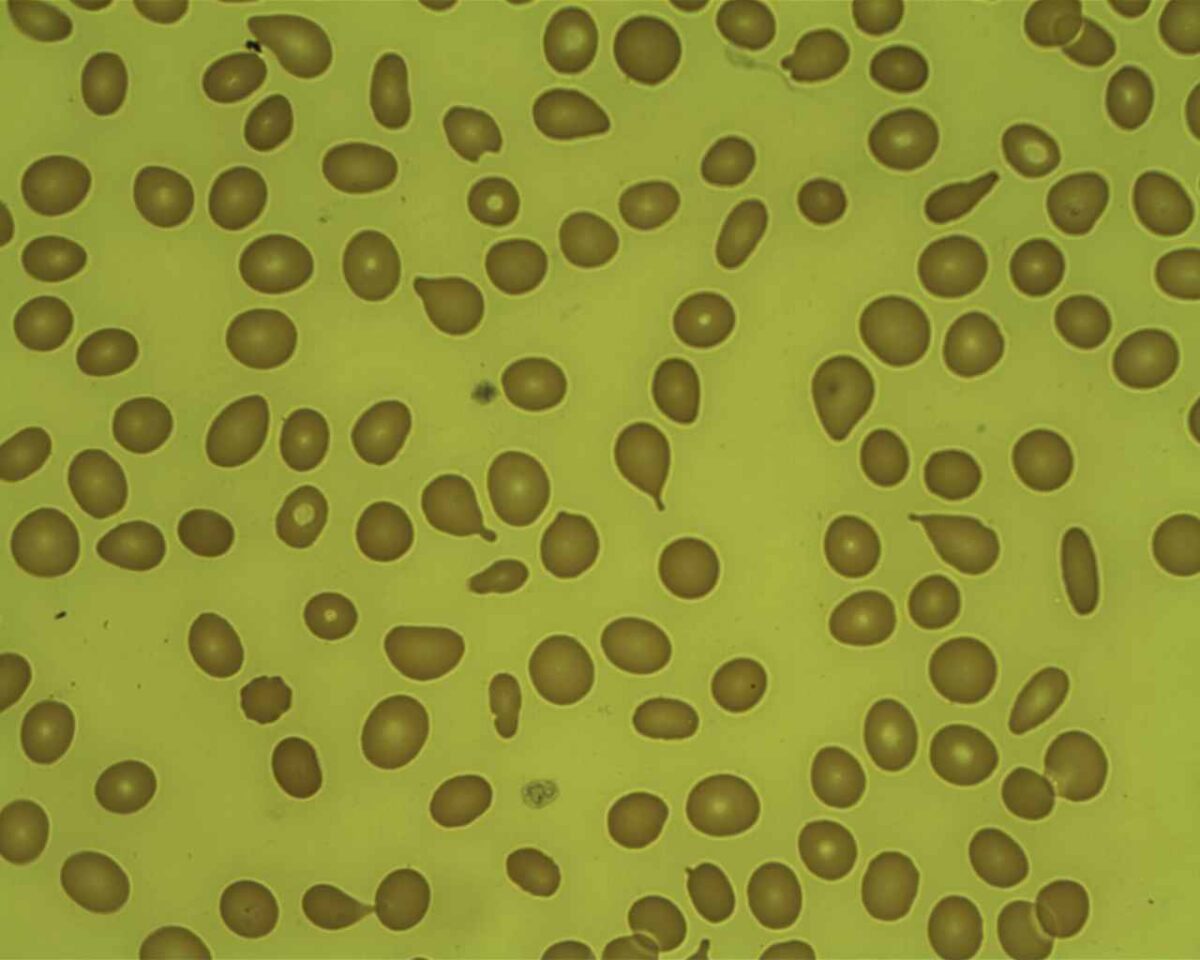
Mielofibrosis: células en forma de lágrima en frotis de sangre periférica
Imagen: “Poiquilocitos en forma de lágrima” por Prof. Osaro Erhabor. Licencia: CC0 1.0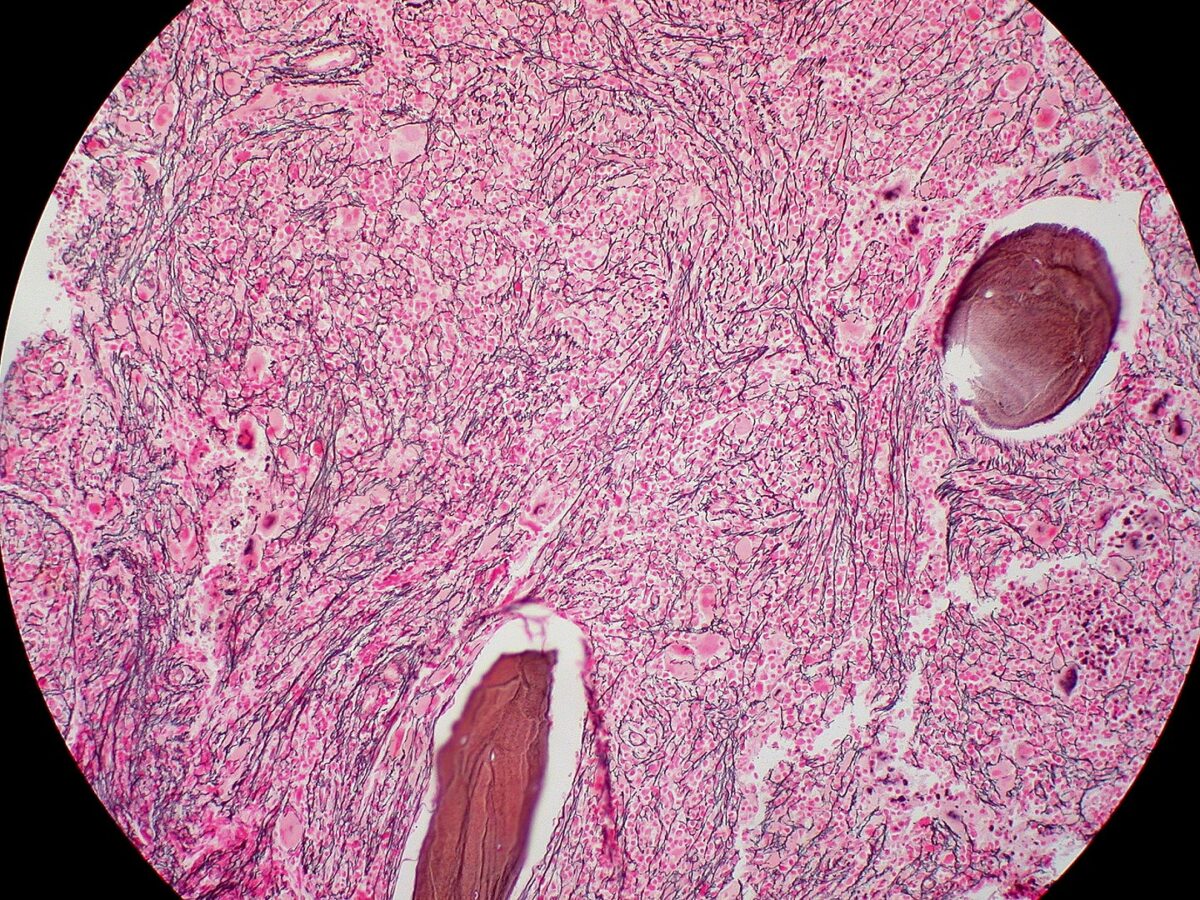
Biopsia de médula ósea de mielofibrosis: fibrosis extensa (tinción de reticulina)
Imagen: “Mielofibrosis, tinción de reticulina (6032644716)” por Ed Uthman. Licencia: CC BY 2.0Para recordar MFP en resumen: La médula ósea está llorando (células de lágrima) porque está fibrosada y es un grifo seco.
Las neoplasias mieloproliferativas se pueden comparar con la siguiente clasificación de la OMS:
| Enfermedad | Mutaciones | Puntos clave |
|---|---|---|
| LMC | BCR-ABL1 (cromosoma Filadelfia) | Proliferación de granulocitos maduros y en proceso de maduración |
| Trombocitemia esencial | JAK2, CALR o MPL | Producción clonal excesiva de plaquetas |
| Policitemia vera | JAK2 | Masa de eritrocitos elevada |
| Mielofibrosis primaria | JAK2, CALR o MPL | Fibrosis obliterante de la médula ósea |
Otros tipos:
La evaluación del riesgo es importante para tomar decisiones de tratamiento.