La miastenia gravis es un trastorno neuromuscular autoinmune caracterizado por debilidad y fatigabilidad de los músculos esqueléticos, causada por la disfunción/destrucción de los receptores de acetilcolina en la unión neuromuscular. La miastenia gravis se presenta con fatiga, ptosis, diplopía, disfagia, dificultades respiratorias y debilidad progresiva en las extremidades, lo que provoca dificultad en el movimiento. El diagnóstico se establece con base en la presentación clínica, detección de anticuerpos y estudios electrofisiológicos. El tratamiento tiene como objetivo aumentar la actividad de la acetilcolina en la unión neuromuscular y la supresión de anticuerpos. Esta enfermedad puede asociarse con timomas e hiperplasia tímica, y en ocasiones está indicada la timectomía. La miastenia gravis puede progresar a una crisis miasténica potencialmente mortal con insuficiencia respiratoria, pero esto se puede prevenir con el tratamiento adecuado. El pronóstico generalmente es bueno con tratamiento, y algunos pacientes pueden lograr una remisión a largo plazo.
Última actualización: Dic 21, 2022
Miastenia gravis es un trastorno autoinmune crónico en el que anticuerpos atacan el complejo de receptor de acetilcolina en la unión neuromuscular.
Existen 2 formas clínicas principales de miastenia gravis:
Además, existen formas más raras de miastenia gravis que afectan principalmente a la población pediátrica:
La miastenia gravis también puede ser clasificada según el perfil serológico de los anticuerpos presentes:

Ptosis en un paciente con miastenia gravis
Imagen: “Myasthenia Gravis” por Posey & Spiller. Licencia: Dominio PúblicoSe realiza una RM o TC de tórax para descartar la posibilidad de un timoma.
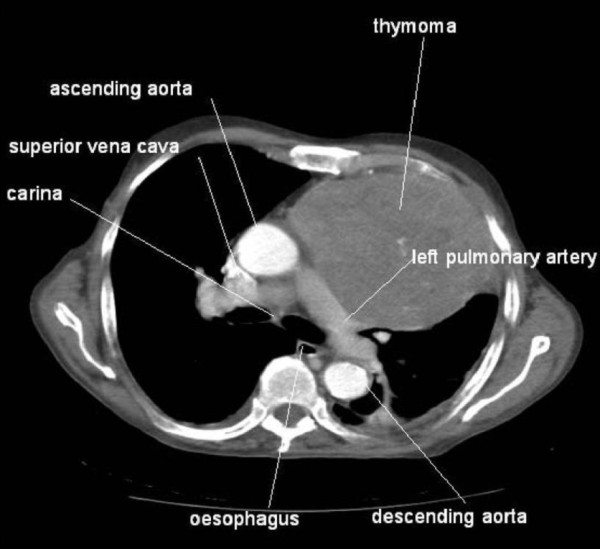
TC que muestra un gran timoma
Imagen: “Association between thymoma and persistent hypothermia: a case report” por Johns RH, Reinhardt AK. Licencia: CC BY 2.0Inhibidores de la acetilcolinesterasa:
Medicamentos inmunosupresores crónicos: