Los inhibidores del sistema renina-angiotensina-aldosterona constituyen una clase importante de medicamentos para el tratamiento de las enfermedades cardiovasculares. Son agentes antihipertensivos de 1ra línea, que además pueden utilizarse como tratamiento en el IM, la insuficiencia cardíaca, la nefropatía diabética y el ictus. Los inhibidores del sistema renina-angiotensina-aldosterona incluyen los IECA, los ARA, los inhibidores directos de la renina, los inhibidores de los receptores de la angiotensina y de la neprilisina y los antagonistas de la aldosterona, que afectan a diferentes componentes de la vía del SRAA. En general, el uso de inhibidores del SRAA provoca una disminución de la vasoconstricción y del volumen sanguíneo. Entre los efectos adversos más comunes se encuentran la hiperpotasemia, la tos, el angioedema y la pancreatitis, que son más frecuentes con el uso de los IECA que de los ARA.
Última actualización: Jul 17, 2023
Los inhibidores del sistema renina-angiotensina-aldosterona constituyen una clase importante de medicamentos para el tratamiento de las enfermedades cardiovasculares y son agentes de 1ra línea para el tratamiento de la hipertensión.
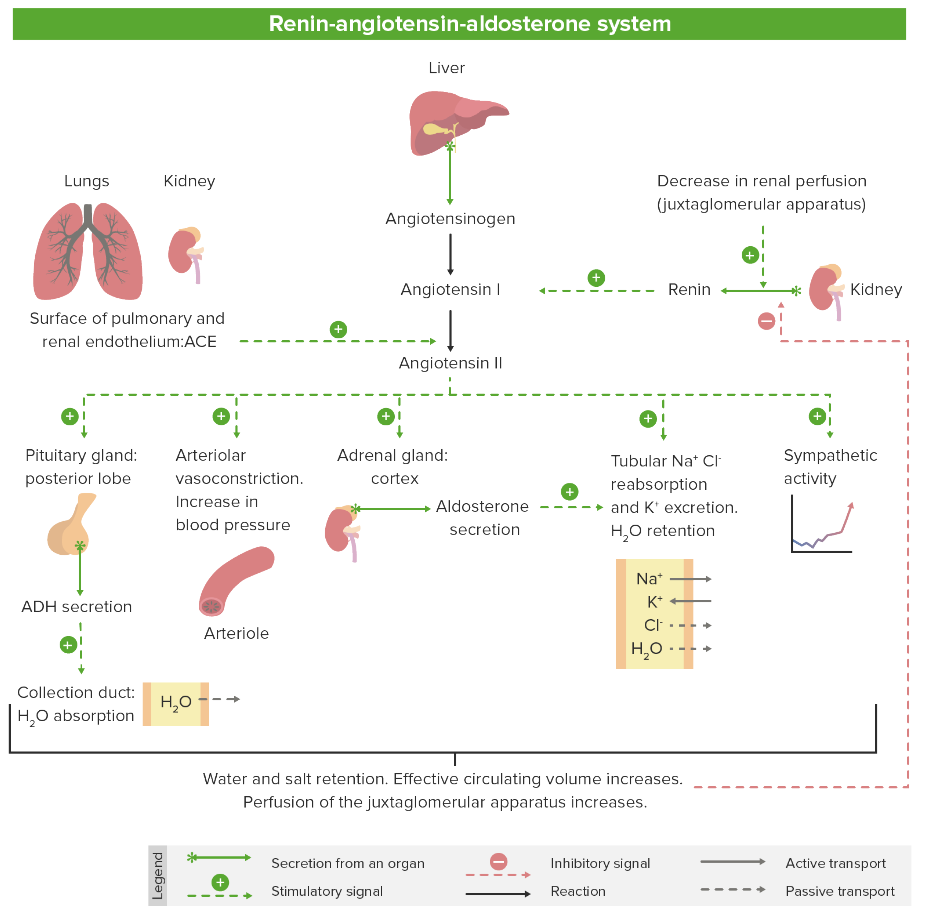
Descripción general del SRAA
Imagen por Lecturio. Licencia: CC BY-NC-SA 4.0Los medicamentos de la clase de los inhibidores del SRAA incluyen:
| Sitio de acción | Clase | Subclase |
|---|---|---|
| Renales | Medicamentos que afectan al SRAA |
|
| Diuréticos |
|
|
| Extrarrenales | Vasodilatadores directos |
|
| Agentes que actúan a través del sistema nervioso simpático |
|
Todos los medicamentos de una misma clase tienen la misma estructura básica, pero diferentes grupos funcionales unidos, lo que explica sus diferentes perfiles farmacocinéticos y de seguridad.
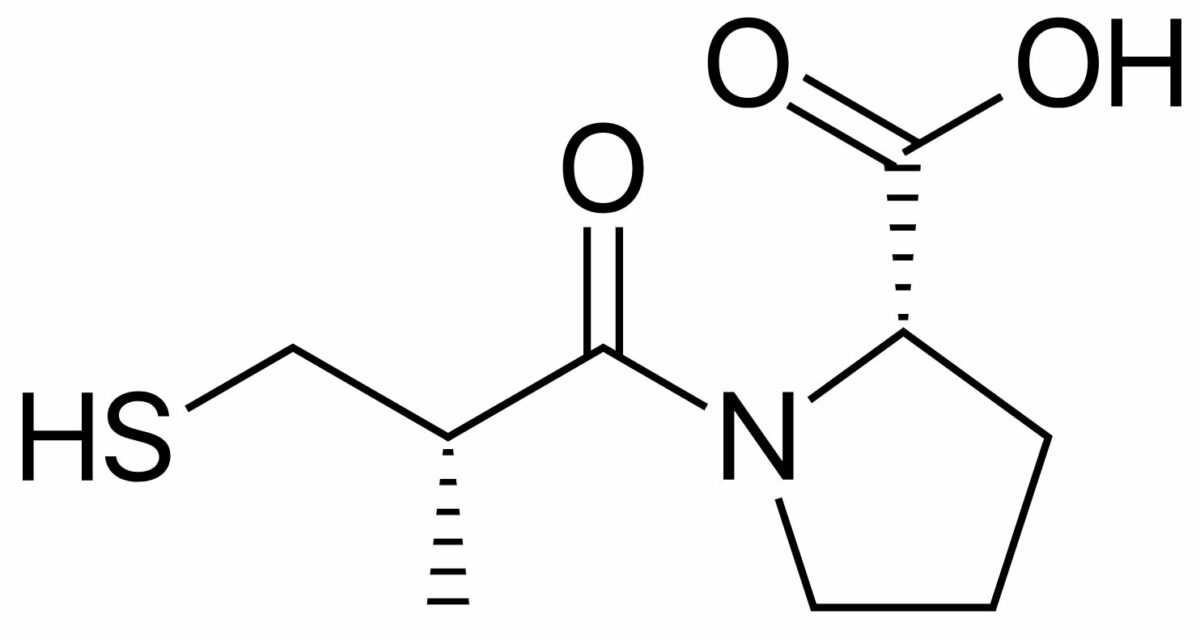
Estructura química del captopril (marca Capoten), un IECA muy utilizado
Imagen: “Captopril structure” por Vaccinationist. Licencia: Dominio Público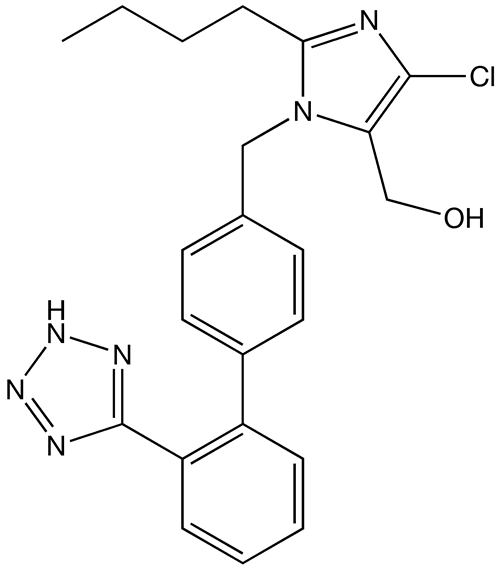
Estructura química del losartán, un ARA ampliamente utilizado
Imagen: “Losartan structure” por Techelf. Licencia: Dominio Público| Clase del medicamento | Mecanismo de acción | Efectos fisiológicos |
|---|---|---|
| IECA | Inhibe la ECA, evitando:
|
Disminución de la resistencia vascular periférica vía:
|
| ARA | Inhiben los receptores de angiotensina-1, impidiendo que ejerzan sus efectos |
|
| DRi | Inhibe directamente la actividad de la renina, bloqueando la conversión del angiotensinógeno en angiotensina I | ↓ Angiotensina I, angiotensina II y aldosterona → ↓ resistencia vascular periférica. |
| ARNI | Combinación de ARA y un inhibidor de la neprilisina:
|
|
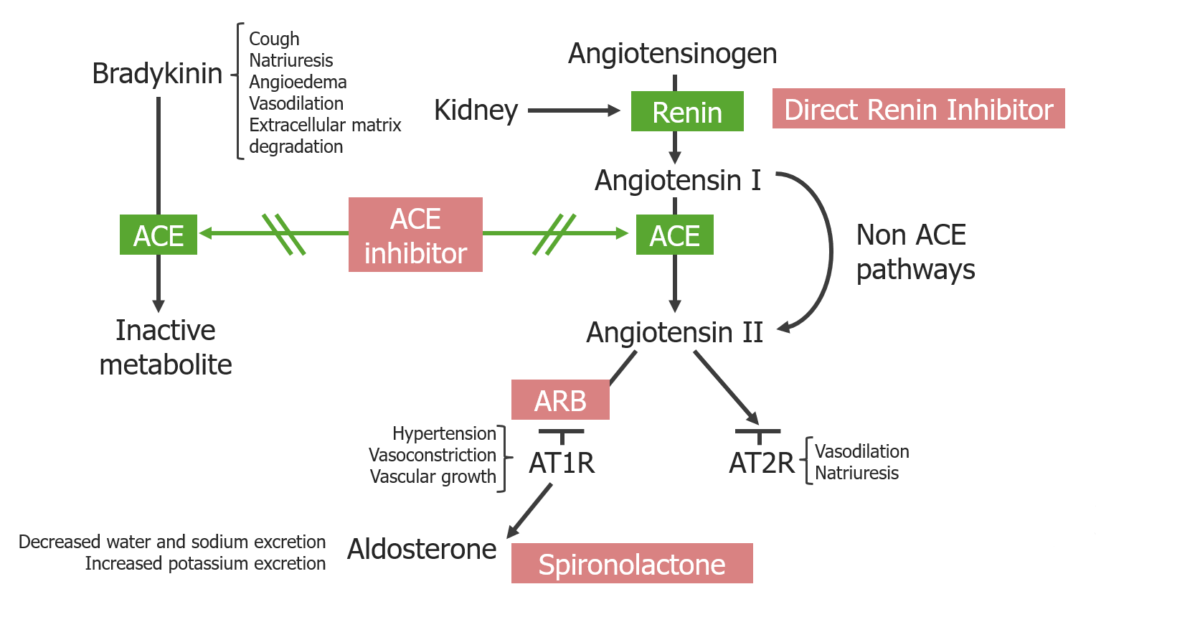
Descripción general de los inhibidores del SRAA y su sitio de acción:
Los inhibidores de la ECA bloquean tanto la degradación de la bradicinina como la generación de angiotensina II.
Los ARA bloquean los receptores de angiotensina II tipo 1. Los inhibidores directos de la renina bloquean la generación de angiotensina I.
La espironolactona bloquea los receptores mineralocorticoides en las células principales de los túbulos renales distales y del conducto colector cortical.
| Medicamento | Absorción | Distribución | Metabolismo | Excreción |
|---|---|---|---|---|
| IECA |
|
La mayoría de los medicamentos tienen una unión mínima a las proteínas y volúmenes de distribución relativamente modestos | Los profármacos se activan por hidrólisis en el hígado; los medicamentos activos no se modifican. |
|
| ARA |
|
|
Metabolismo hepático |
|
| DRI: aliskiren |
|
Unión a proteínas: 50% | Grado de metabolismo hepático desconocido |
|
Los efectos adversos más comunes de los IECA y los ARA se muestran en la tabla.
| Síntoma | IECA | ARA (y ARNI) |
|---|---|---|
| Hiperpotasemia | 1% | 0,3% |
| Tos | 10%‒20% | 1 por cada 1 000 |
| Pancreatitis | 1 por cada 5 000 |
|
| Angioedema | 1 por cada 2 000 | 1 por cada 20 000 |
Los efectos secundarios adicionales pueden incluir:
| Medicamentos | Mecanismos | Efectos fisiológicos | Indicaciones |
|---|---|---|---|
| IECA | Inhibe la ECA, que:
|
|
|
| ARA | Inhiben los receptores de angiotensina-1, impidiendo que ejerzan sus efectos |
|
|
| Bloqueadores de los canales de calcio | Se unen e inhiben los canales de calcio de tipo L en los miocitos cardíacos y el músculo liso vascular |
|
|
| Betabloqueadores | Inhiben los receptores β de las catecolaminas con distinta afinidad por los receptores β1 frente a los β2 |
|
|
| Diuréticos tiazídicos | ↓ Reabsorción de NaCl en el túbulo contorneado distal mediante la inhibición del cotransportador de Na+/cloro |
|
|
| Diuréticos de asa | Inhiben el cotransportador luminal de Na+/K+/cloro en la rama ascendente gruesa del asa de Henle |
|
|
| Diuréticos ahorradores de K+ |
|
|
|