La hemostasia se refiere a los procesos corporales innatos y escalonados que ocurren después de la lesión de un vaso, lo que da como resultado la formación de coágulos y el cese del sangrado. La hemostasia ocurre en 2 fases, primaria y secundaria. La hemostasia primaria implica la adhesión, activación y agregación plaquetaria al endotelio vascular dañado, formando un tapón que detiene el sangrado temporalmente. La hemostasia secundaria implica la activación de la cascada de coagulación que da como resultado la formación de un tapón más estable. Finalmente, a medida que se repara el vaso, el coágulo se descompone en la fase fibrinolítica.
Última actualización: Jul 30, 2023
La hemostasia se refiere a los procesos corporales innatos y escalonados que ocurren después de la lesión de un vaso, lo que resulta en la formación de coágulos.
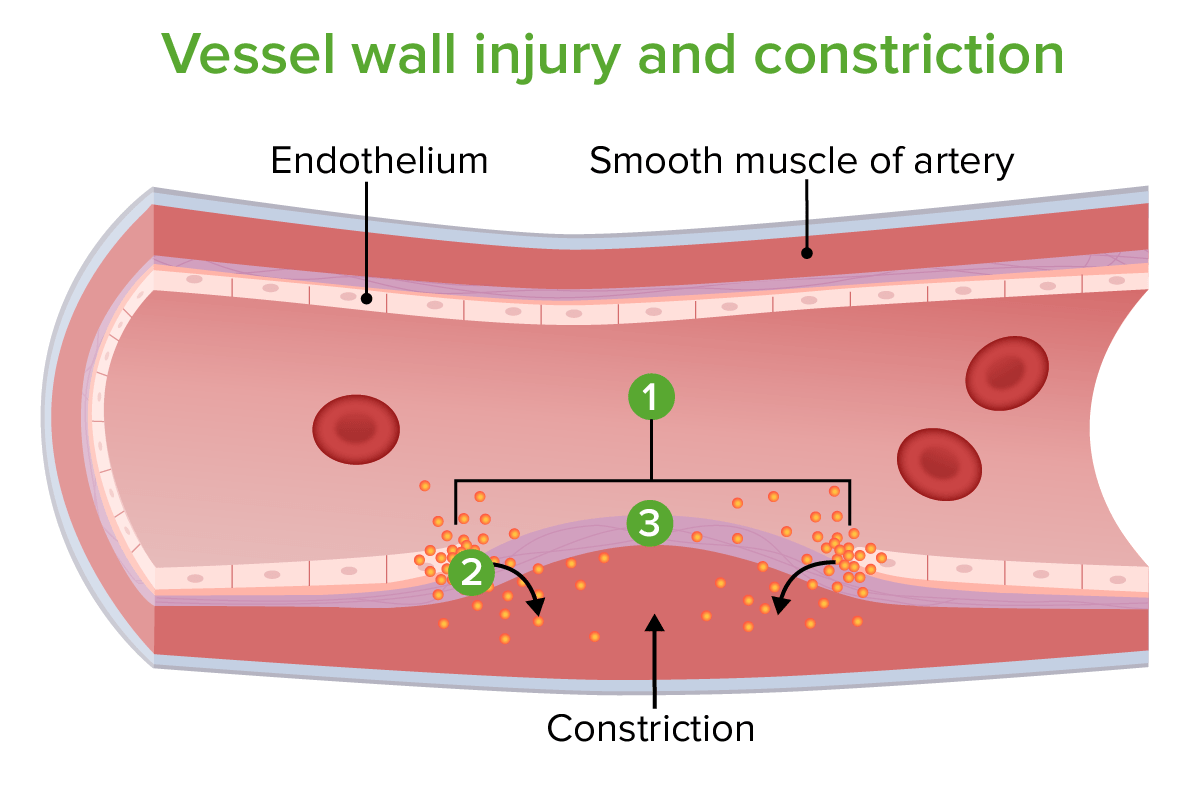
Lesión y constricción de la pared del vaso:
Lugar de la lesión
Constricción causada por la liberación de endotelina
Fibras de colágeno expuestas
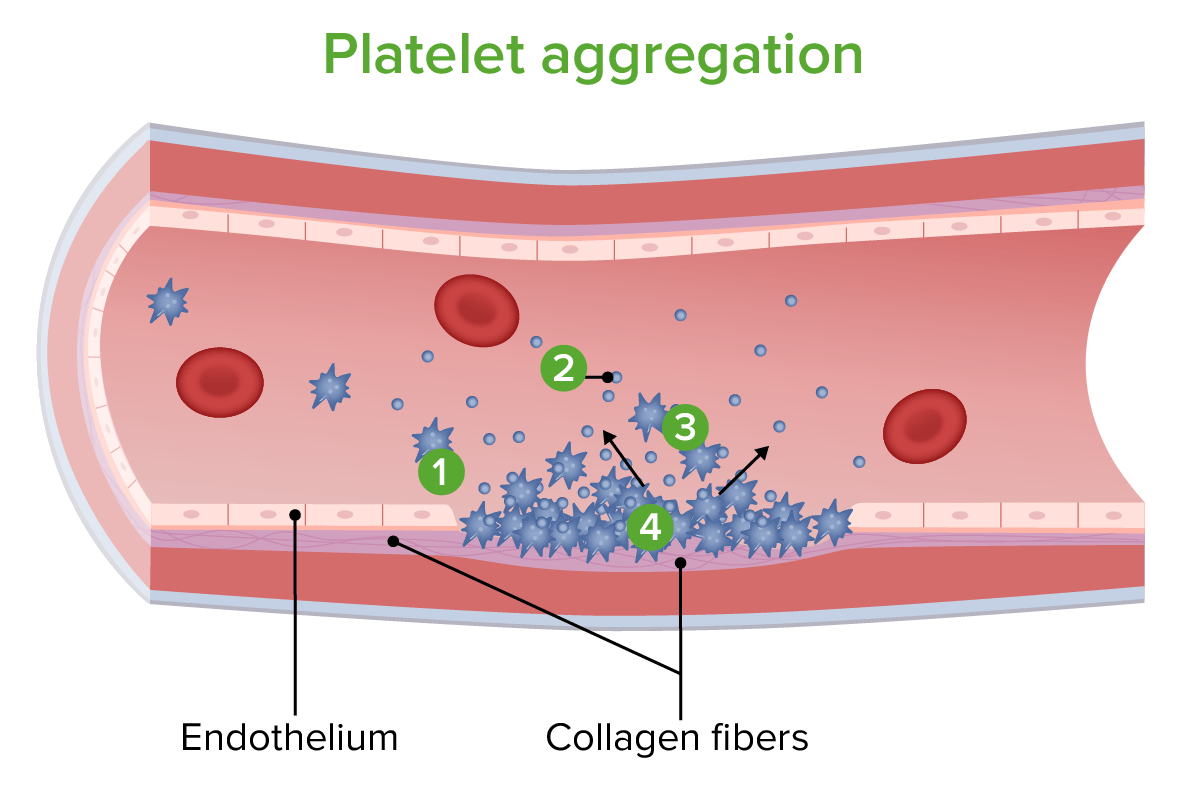
Agregación de plaquetas:
Las plaquetas se adhieren a las fibras de colágeno expuestas.
Las plaquetas liberan sustancias químicas para inducir la vasoconstricción y atraer más plaquetas.
Se reúnen más plaquetas.
Las plaquetas se agrupan para reparar la pared del vaso.
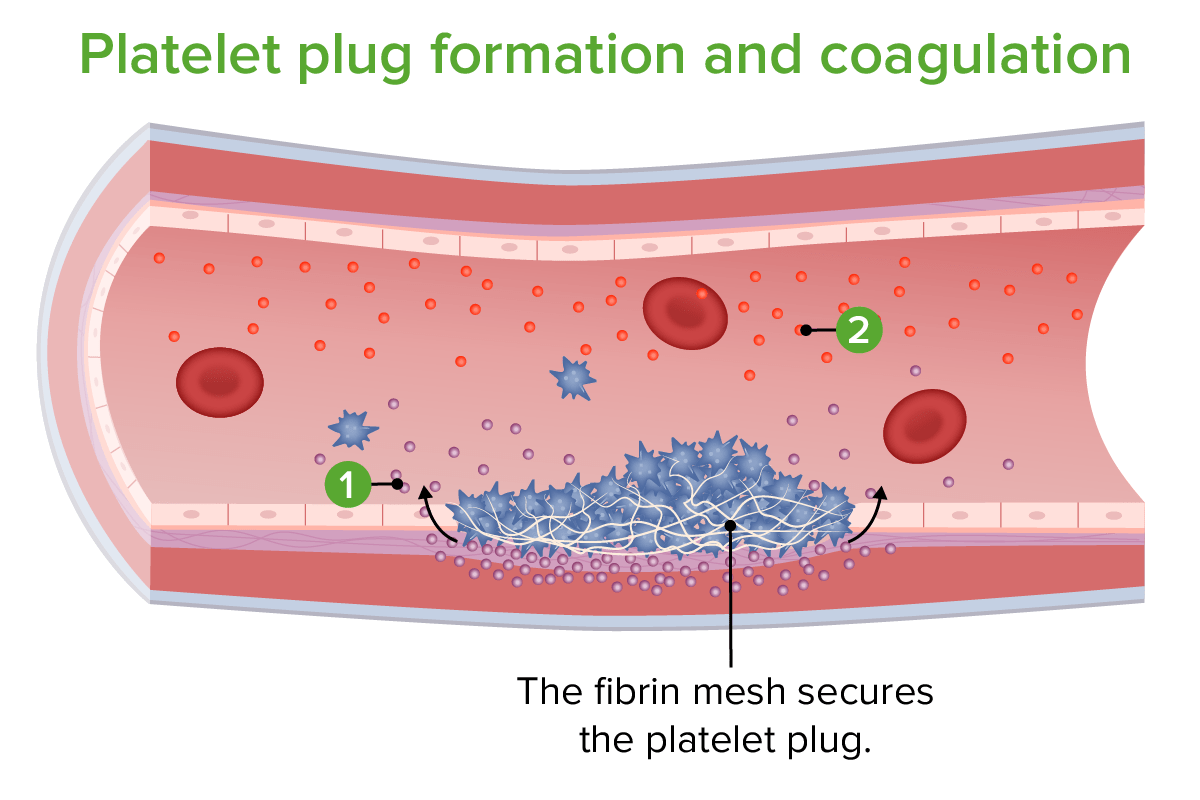
Formación de tapones plaquetarios y coagulación:
Liberación del factor tisular
Liberación de factores de coagulación
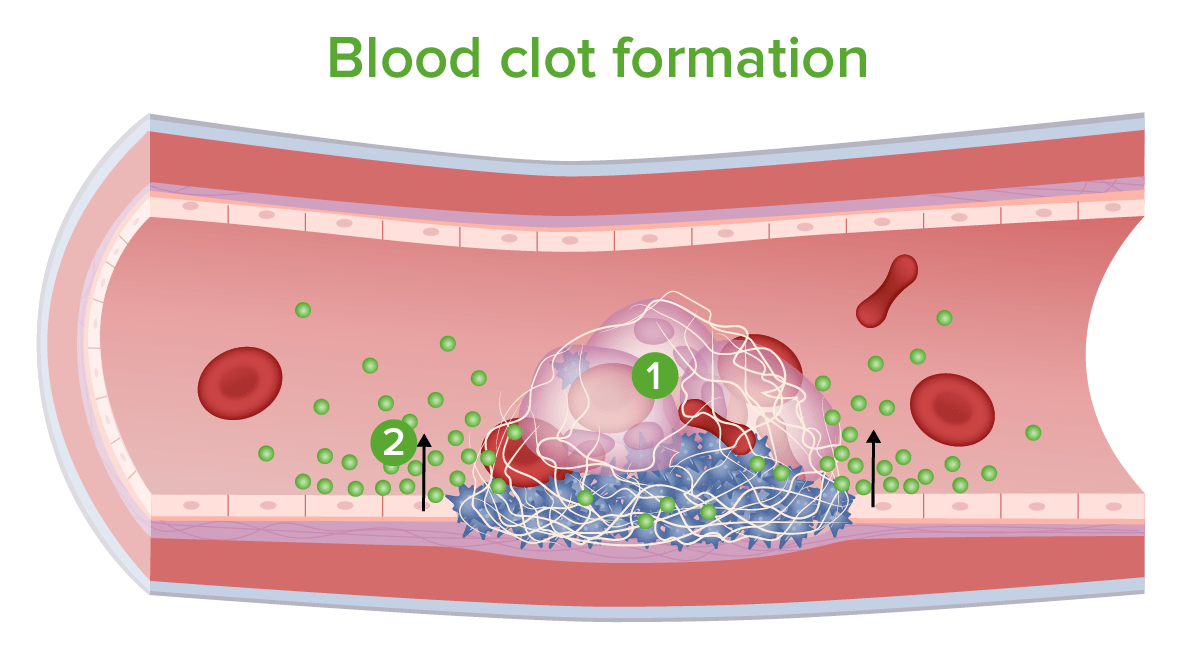
Formación de coágulos de sangre:
Los glóbulos rojos y blancos quedan atrapados en la malla.
Se liberan inhibidores de la coagulación y otras sustancias químicas.
Los vasos lesionados se vasoconstriñen después de una lesión endotelial. Además, la exposición de la sangre a los componentes subendoteliales desencadena la formación del tapón de plaquetas.
La lesión endotelial da como resultado una vasoconstricción transitoria a través de:
Después de una lesión de las células endoteliales, se producen los siguientes procesos con las plaquetas para formar un tapón plaquetario temporal (también conocido como hemostasia primaria):
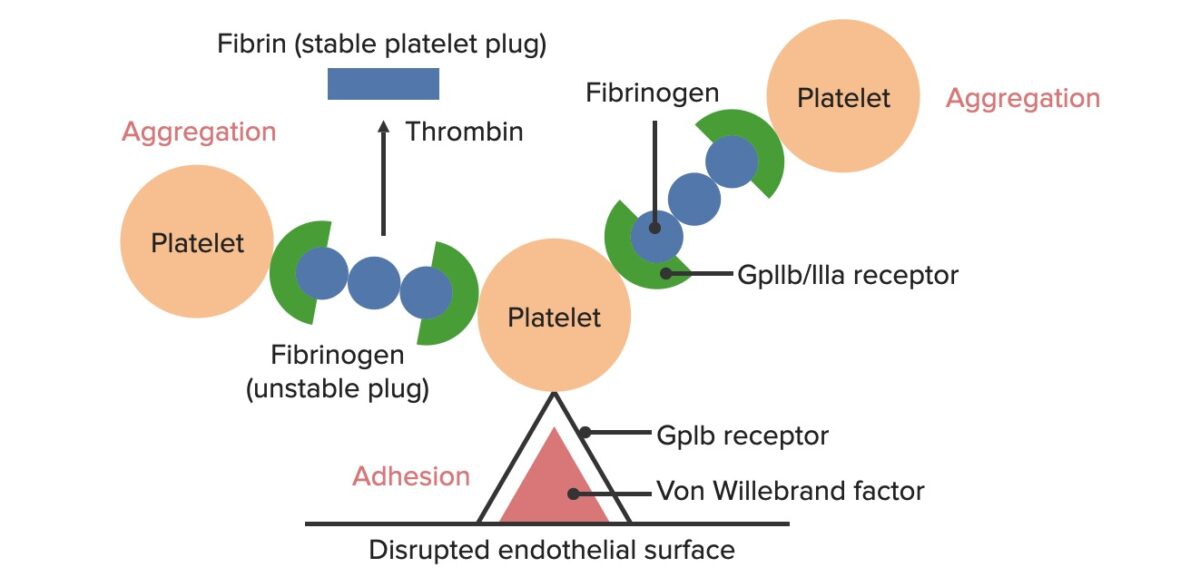
Formación del tapón hemostático temporal:
La superficie endotelial rota expone el factor de von Willebrand (vWF) a la sangre que pasa. Las plaquetas se unen al vWF a través de sus receptores GpIb y se activan. La activación plaquetaria desencadena la secreción de adenosin difosfato (ADP, por sus siglas en inglés), que estimula la expresión de los receptores GpIIb/IIIa en las plaquetas. Los receptores GpIIb/IIIa se unen al fibrinógeno y a una plaqueta en cada extremo, lo que hace que las plaquetas se agreguen. A medida que más plaquetas se unen entre sí, se forma un tapón de plaquetas. A medida que se activa la cascada de coagulación, la trombina convierte el fibrinógeno más débil en fibrina más fuerte, creando un coágulo mucho más estable.
La exposición de la sangre a los componentes subendoteliales en el sitio de la lesión hace que las plaquetas se adhieran al sitio de la lesión.
Las plaquetas activadas mejoran aún más la adhesión y agregación plaquetaria y estimulan la secreción.
Las plaquetas contienen 2 tipos de gránulos. Estos gránulos liberan diversas sustancias cuando se activan las plaquetas.
La cascada de la coagulación es una serie de reacciones que finalmente genera un fuerte coágulo de fibrina reticulado. Este proceso también se conoce como hemostasia secundaria.
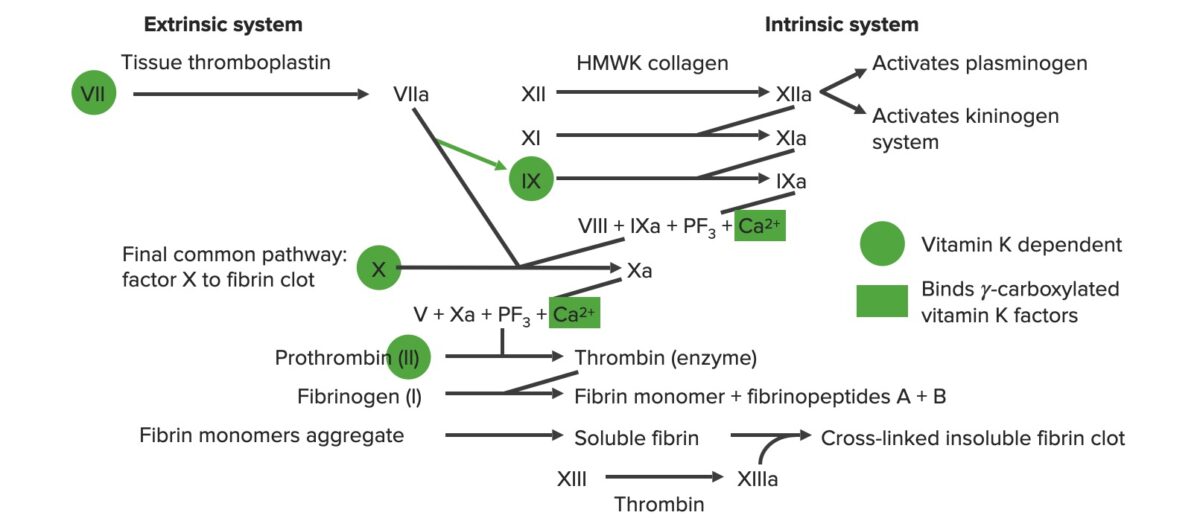
Descripción general de la cascada de la coagulación
a: forma activada
PF3: factor plaquetario 3 (fosfolípidos)
Los factores de coagulación son proteasas de serina similares a la tripsina y se indican con números romanos.
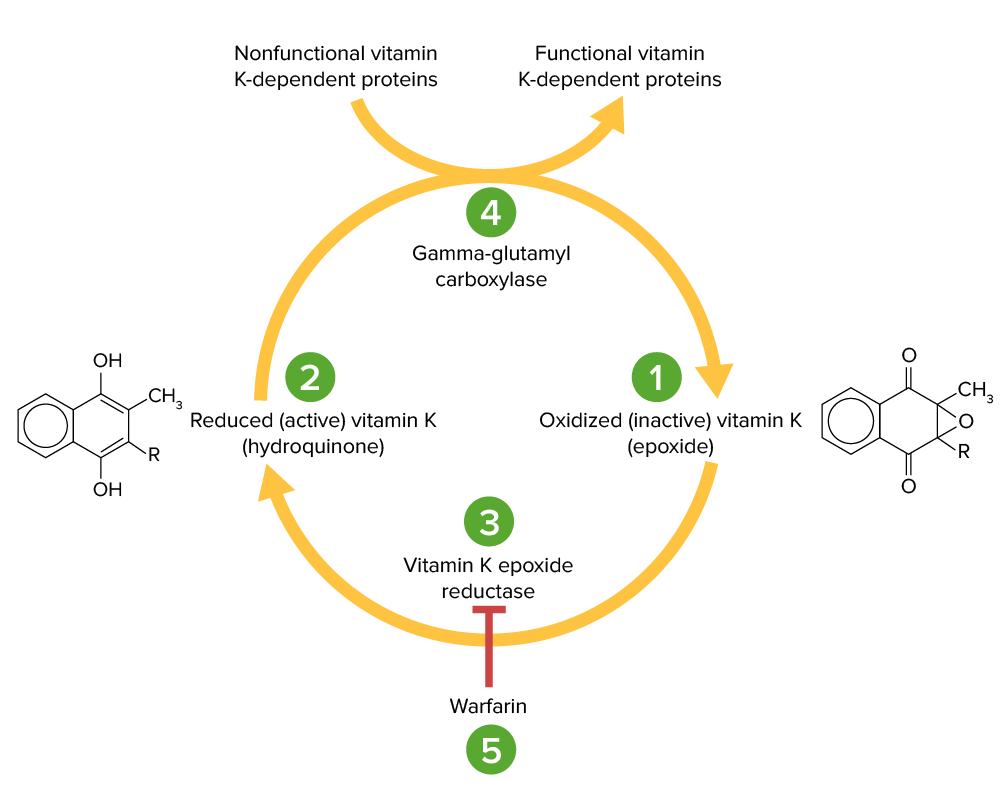
Ciclo de la vitamina K:
La vitamina K epóxido (1) es inactiva y se convierte en su forma activa reducida, la vitamina K hidroquinona (2), mediante la vitamina K epóxido reductasa (VKOR; 3). La vitamina K hidroquinona es un cofactor en la carboxilación de residuos de glutamato específicos dentro de las proteínas dependientes de la vitamina K (factores II, VII, IX, X, proteína C y S), un proceso que es necesario para activarlas. La reacción de carboxilación es catalizada por la gamma-glutamil carboxilasa (4). La vitamina K hidroquinona se oxida a la forma epóxido cuando actúa como cofactor, pero luego es reciclada de nuevo a la forma hidroquinona por el VKOR. La warfarina inhibe el VKOR (5), de modo que la vitamina K no puede reciclarse de su forma oxidada a la reducida. Así, las proteínas dependientes de la vitamina K no pueden activarse.
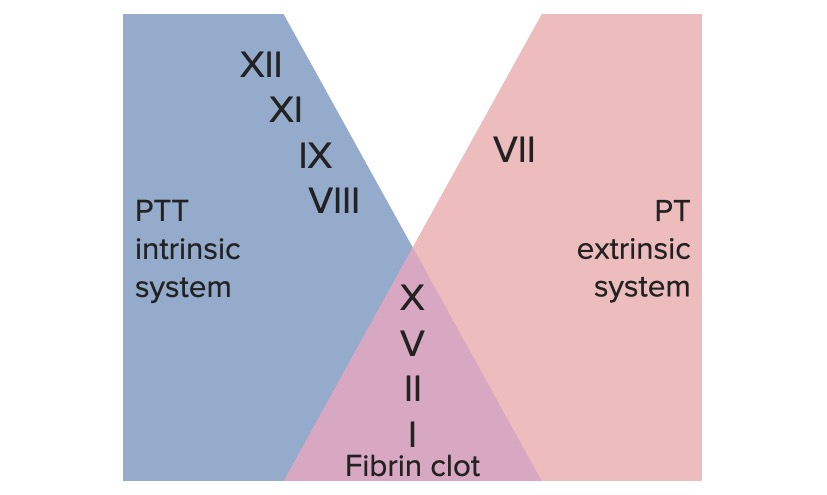
La vía extrínseca es el principal mecanismo fisiológico por el cual se inicia la coagulación.
La vía intrínseca es la principal responsable de la amplificación de la activación del factor X. El factor X es activado por la trombina inicial generada por la vía extrínseca/común, pero también puede activarse directamente por una lesión endotelial.
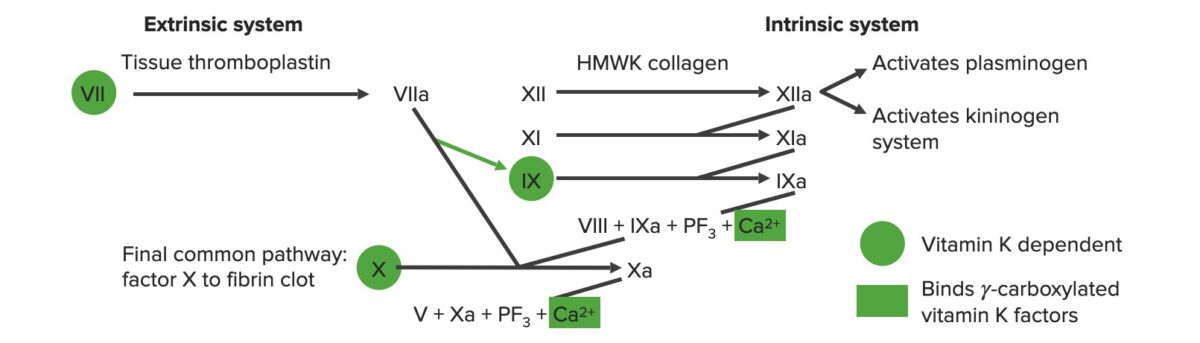
Los sistemas de coagulación extrínsecos e intrínsecos
Imagen por Lecturio.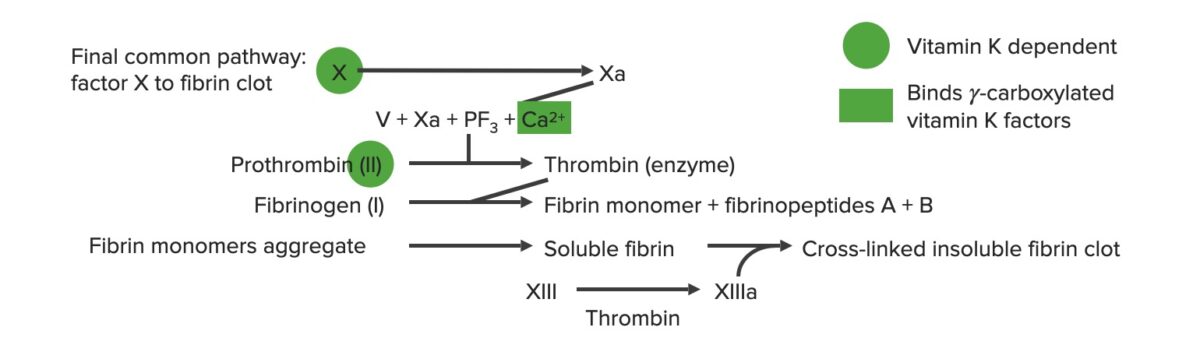
La vía común final
a: forma activada
PF3: factor plaquetario 3 (fosfolípidos)
El cuerpo produce varias sustancias que inhiben la unión, agregación y secreción de plaquetas, así como también funcionan como anticoagulantes naturales. Estos mecanismos limitan la coagulación a sitios focales específicos y mantienen la sangre líquida.
El sistema fibrinolítico funciona para eliminar el coágulo después de que se repara el vaso y el proceso se lleva a cabo principalmente mediante la plasmina.
Evaluación de laboratorio de hemostasia normal
Hemofilia: un raro trastorno de la coagulación de la sangre en el que el cuerpo carece de factores de coagulación de la sangre (factor VIII en la hemofilia A; factor IX en la hemofilia B). Los individuos afectados presentan sangrado anormal que puede ocurrir espontáneamente o después de un traumatismo menor. Estos individuos pueden sangrar en los espacios articulares y desarrollar una hemorragia interna potencialmente mortal.