Los eritrocitos, o glóbulos rojos, son las células más abundantes de la sangre. Si bien los eritrocitos en el feto se producen inicialmente en el saco vitelino y luego en el hígado, la médula ósea es el principal lugar de producción. La eritropoyesis comienza con las células madre hematopoyéticas, que se convierten en progenitores comprometidos con el linaje y se diferencian en eritrocitos maduros. El proceso se produce por etapas, y la extrusión de los núcleos y los orgánulos se produce antes de la maduración. Así, los eritrocitos maduros carecen de núcleo y tienen una forma bicóncava. Los eritrocitos transportan hemoglobina y su forma permite un transporte eficaz del oxígeno. Cada día se producen miles de millones de eritrocitos, ya que su vida media es de aproximadamente 120 días. Los eritrocitos que cumplen con su ciclo son eliminados por los macrófagos del bazo, el hígado y la médula ósea.
Última actualización: Mar 9, 2022
Los eritrocitos, también llamados glóbulos rojos, son estructuras terminalmente diferenciadas que carecen de núcleo, pero que están llenas de hemoglobina portadora de oxígeno. Los eritrocitos son las células más abundantes de la sangre.
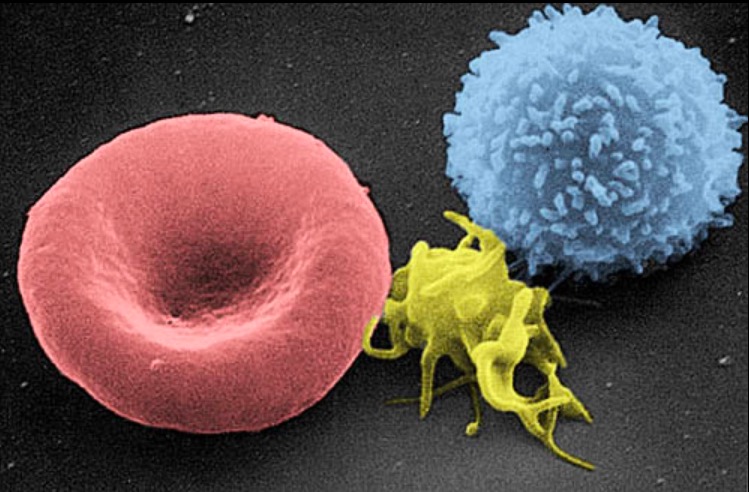
Micrografía electrónica de barrido de una célula sanguínea:
De izquierda a derecha: eritrocito humano, trombocito (plaqueta) y leucocito
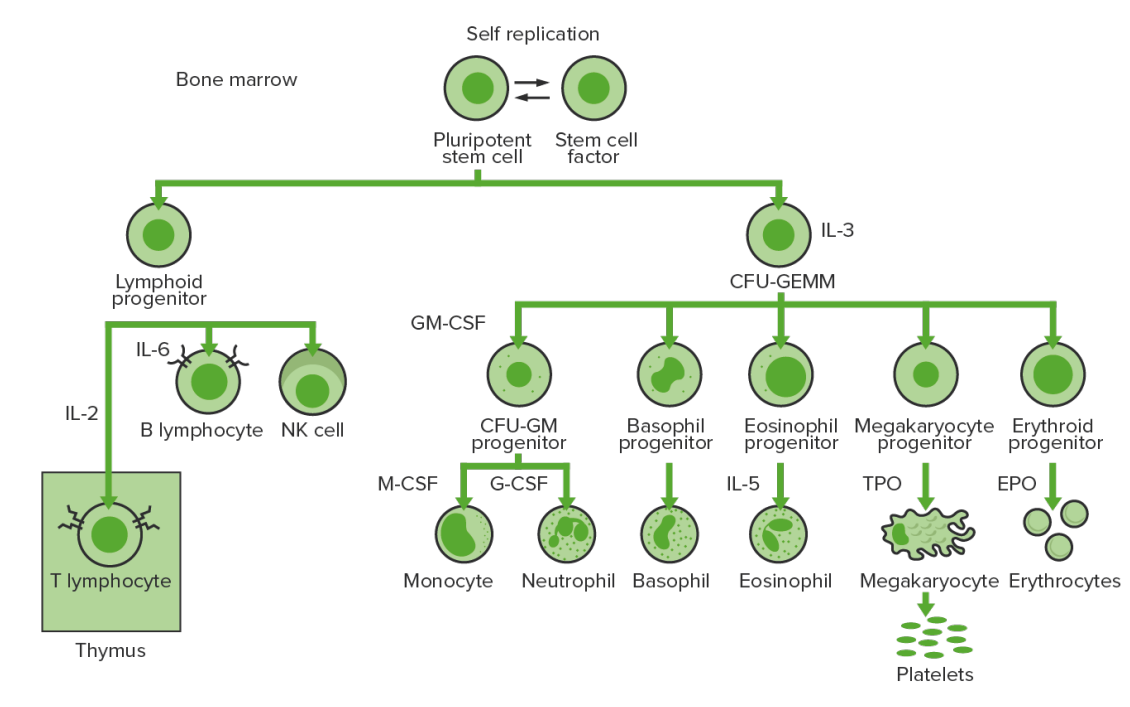
Hematopoyesis de la médula ósea: proliferación y diferenciación de los elementos formados de la sangre.
CFU-GEMM: unidad formadora de colonias de granulocitos, eritrocitos, monocitos y megacariocitos
CFU-GM: unidad formadora de colonias–granulocitos–macrófagos
GM-CSF: factor estimulante de colonias de granulocitos y macrófagos
M-CSF: factor estimulante de colonias de macrófagos
G-CSF: factor estimulante de colonias de granulocitos
NK: Linfocito Natural Killer
TPO: trombopoyetina
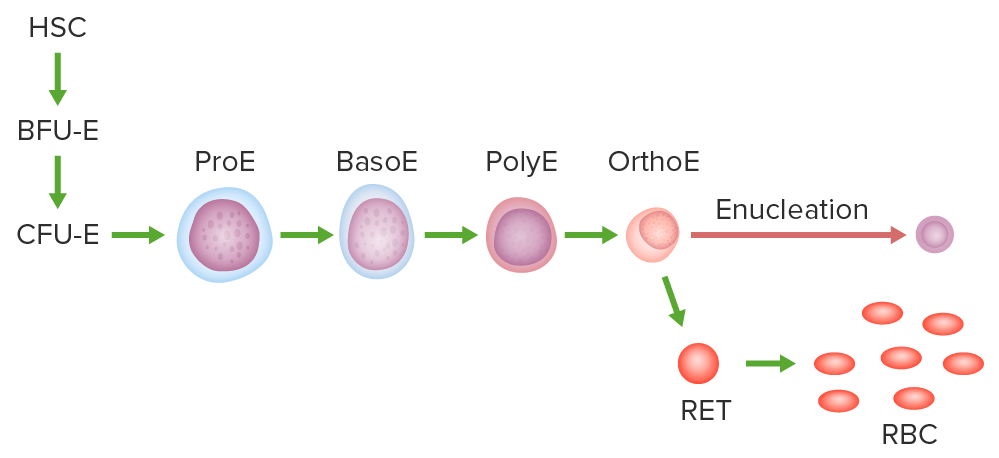
Vía de la eritropoyesis:
Célula madre hematopoyética, unidad formadora de colonias eritroides en ramillete o el progenitor más temprano comprometido, unidad eritroide formadora de colonias, proeritroblasto (ProE), basófilo, policromático y eritroblasto ortocromático.
El eritroblasto ortocromático se enuclea y se convierte en un reticulocito. Tras la expulsión o digestión de los orgánulos, se forma el glóbulo rojo maduro.
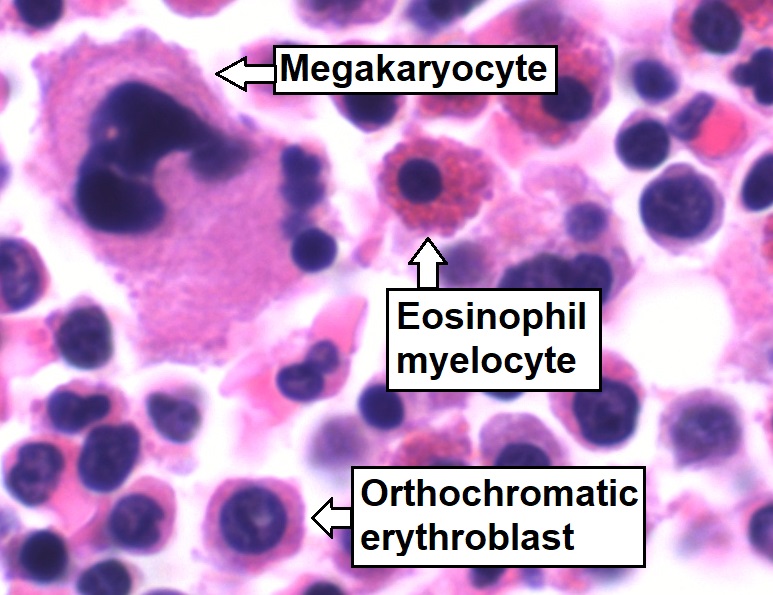
Aspirado de médula ósea que muestra una hematopoyesis trilineal normal:
Células mielomonocíticas (etiquetadas como Eosinophil myelocyte), células eritroides (etiquetadas como Orthochromatic erythroblast) y células megacariocíticas
| Citoquinas y factores de crecimiento | Actividades | Fuente |
|---|---|---|
| Factor de Células Madre (SCF, por sus siglas en inglés) | Estimula todas las células progenitoras hematopoyéticas | Células estromales de la médula ósea |
| GM-CSF | Estimula las células progenitoras mieloides | Células endoteliales, células T |
| EPO | Estimula la eritropoyesis, incluida la diferenciación | Riñón, hígado |
| IL-3 | Mitógeno para todas las células progenitoras de granulocitos y megacariocitos/eritrocitos | Células T colaboradoras |
Otros factores: