El pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance de la sangre está estrictamente regulado dentro del rango de 7,35–7,45 para garantizar funciones fisiológicas adecuadas. Cada día se generan grandes cantidades de ácido a través de procesos normales (respiración aeróbica/anaeróbica e ingesta dietética), y estos se manejan y eliminan de manera eficiente mediante amortiguadores en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum la sangre, el sistema respiratorio y el sistema renal. Cuando estos sistemas reguladores se alteran, se producen trastornos del equilibrio ácido-base, que incluyen acidosis Acidosis A pathologic condition of acid accumulation or depletion of base in the body. The two main types are respiratory acidosis and metabolic acidosis, due to metabolic acid build up. Respiratory Acidosis respiratoria, alcalosis respiratoria, acidosis Acidosis A pathologic condition of acid accumulation or depletion of base in the body. The two main types are respiratory acidosis and metabolic acidosis, due to metabolic acid build up. Respiratory Acidosis metabólica y alcalosis metabólica.
Last updated: Dec 15, 2025
El pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance es la medida cuantitativa de la acidez o basicidad de una solución.
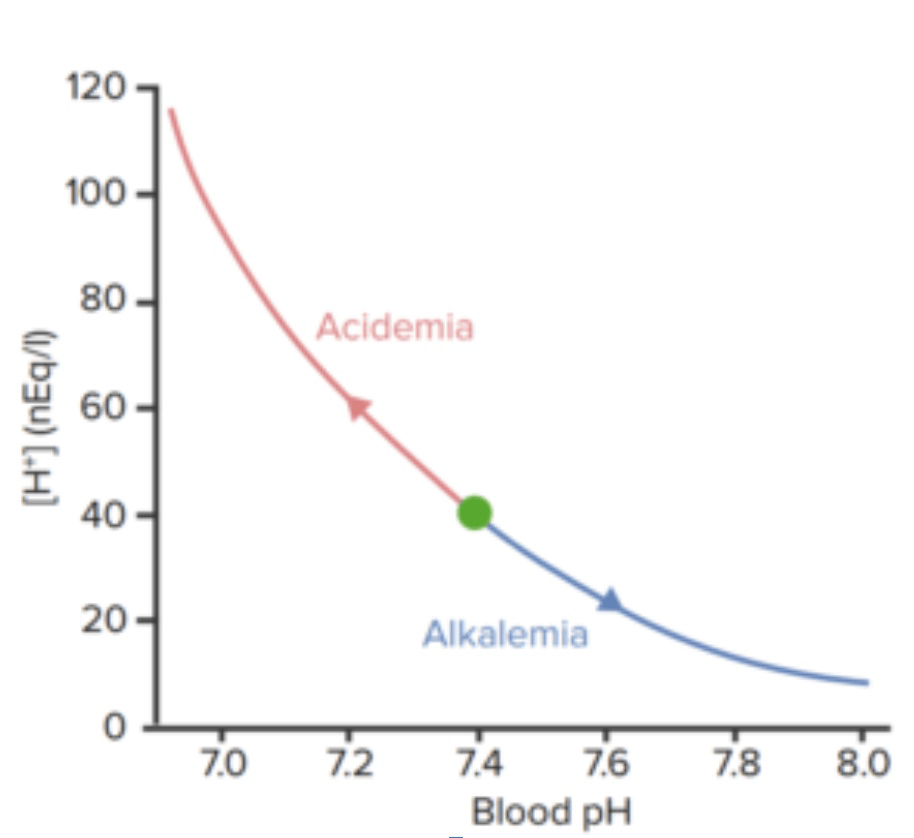
Relación entre el pH de la sangre y la concentración de iones de hidrógeno.
Imagen por Lecturio.| Compartimiento | pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance |
|---|---|
| Secreciones gástricas ( en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum condiciones de máxima acidez) | 0,7 |
| Lisosoma | 5,5 |
| Gránulos de cromafina | 5,5 |
| Neutro H2O a 37 ° C | 6,81 |
| Citosol de una célula típica | 6,0–7,4 |
| LCR | 7,3 |
| Plasma Plasma The residual portion of blood that is left after removal of blood cells by centrifugation without prior blood coagulation. Transfusion Products sanguíneo arterial | 7,35–7,45 |
| Matriz interna mitocondrial | 7,5 |
| Secreciones pancreáticas | 8,1 |
Las concentraciones relativas de ácidos y bases Bases Usually a hydroxide of lithium, sodium, potassium, rubidium or cesium, but also the carbonates of these metals, ammonia, and the amines. Acid-Base Balance en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum la sangre determinan su pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance. Los LOS Neisseria amortiguadores proporcionan una solución a corto plazo para las alteraciones de este equilibrio antes de que los LOS Neisseria pulmones y los LOS Neisseria riñones puedan actuar definitivamente para restablecer el equilibrio.
Los LOS Neisseria ácidos son compuestos que pueden donar protones (H+) o aceptar electrones.
Las bases Bases Usually a hydroxide of lithium, sodium, potassium, rubidium or cesium, but also the carbonates of these metals, ammonia, and the amines. Acid-Base Balance son compuestos que pueden aceptar protones (H+) o donar electrones.
Los LOS Neisseria amortiguadores son sustancias que consumen o liberan iones de hidrógeno (H+) para estabilizar el pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance.
| Gasometría arterial normal | Gasometría arterial ácida | Gasometría arterial alcalótica | |
|---|---|---|---|
| HCO 3– | 24 mEq/L | 26 mEq/L | 22 mEq/L |
| PaCO 2 | 40 mm Hg | 60 mm Hg | 20 mm Hg |
| pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance | 7,40 | 7,26 | 7,66 |
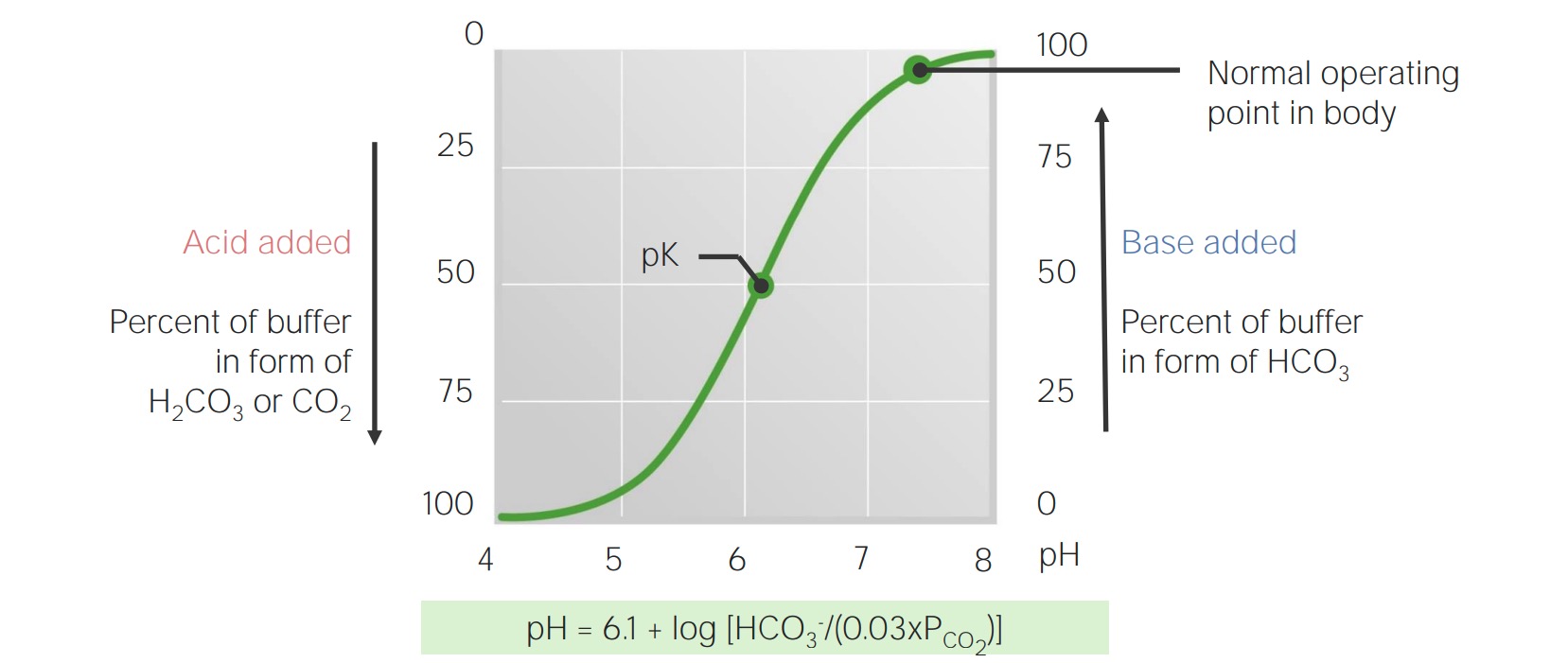
Curva de valoración del bicarbonato en sangre
Imagen por Lecturio.El cuerpo produce aproximadamente 15 000 mmol de ácidos volátiles y 70 mmol de ácidos no volátiles al AL Amyloidosis día. Los LOS Neisseria pulmones y los LOS Neisseria riñones trabajan en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum conjunto para eliminar esta carga ácida diaria, lo que evita que la capacidad amortiguadora de la sangre se sobrepase y le permite mantener un pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance normal.
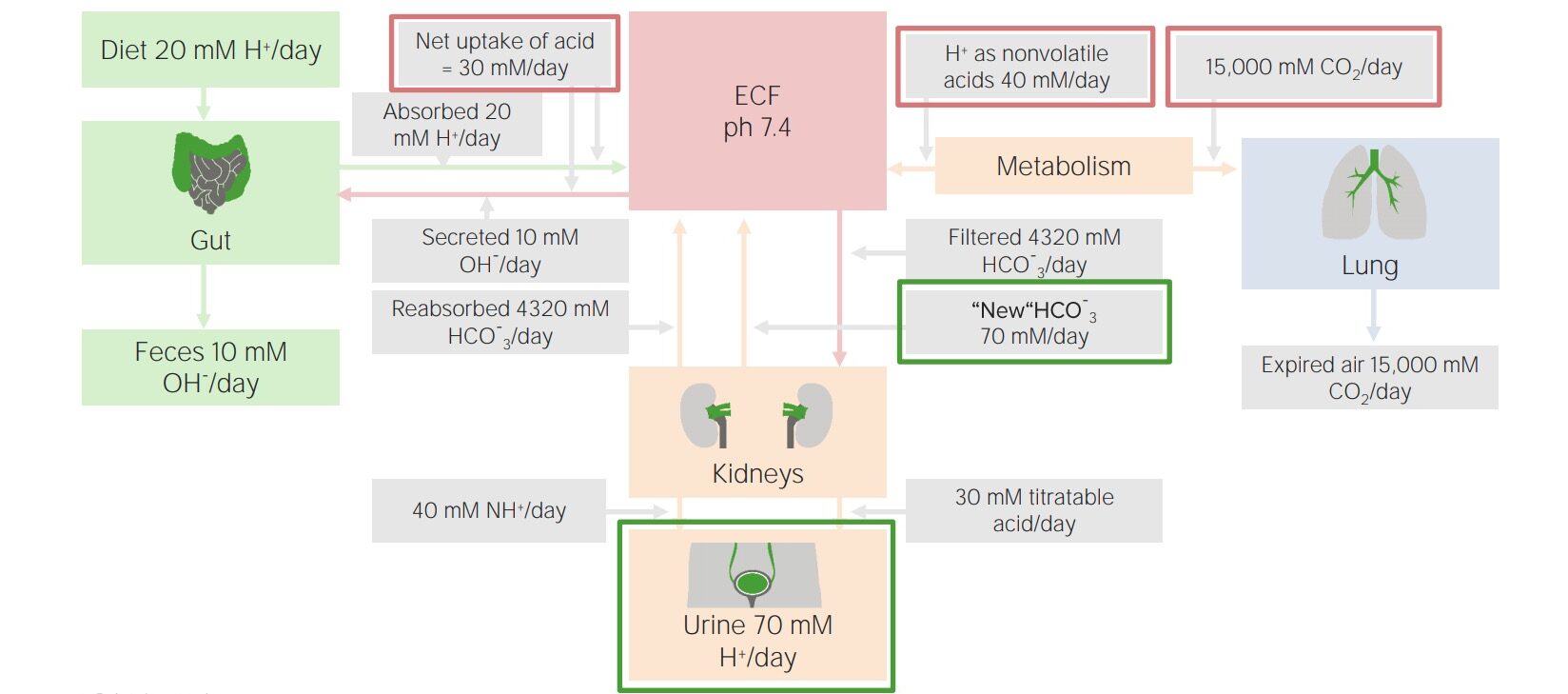
Factores involucrados en el equilibrio ácido-base diario
Imagen por Lecturio.Los LOS Neisseria riñones son los LOS Neisseria principales responsables de la eliminación de los LOS Neisseria ácidos fijos (no volátiles), aproximadamente 70 mmol al AL Amyloidosis día. Previenen la excreción de bicarbonato y también combinan la excreción de ácido con la nueva generación de bicarbonato para que el sistema tampón de bicarbonato esté siempre disponible a plena capacidad.
El bicarbonato se filtra libremente en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum el glomérulo y luego se reabsorbe el 100% (80% en EN Erythema nodosum is an immune-mediated panniculitis (inflammation of the subcutaneous fat) caused by a type IV (delayed-type) hypersensitivity reaction. It commonly manifests in young women as tender, erythematous nodules on the shins. Erythema Nodosum el túbulo proximal) a través del siguiente proceso:
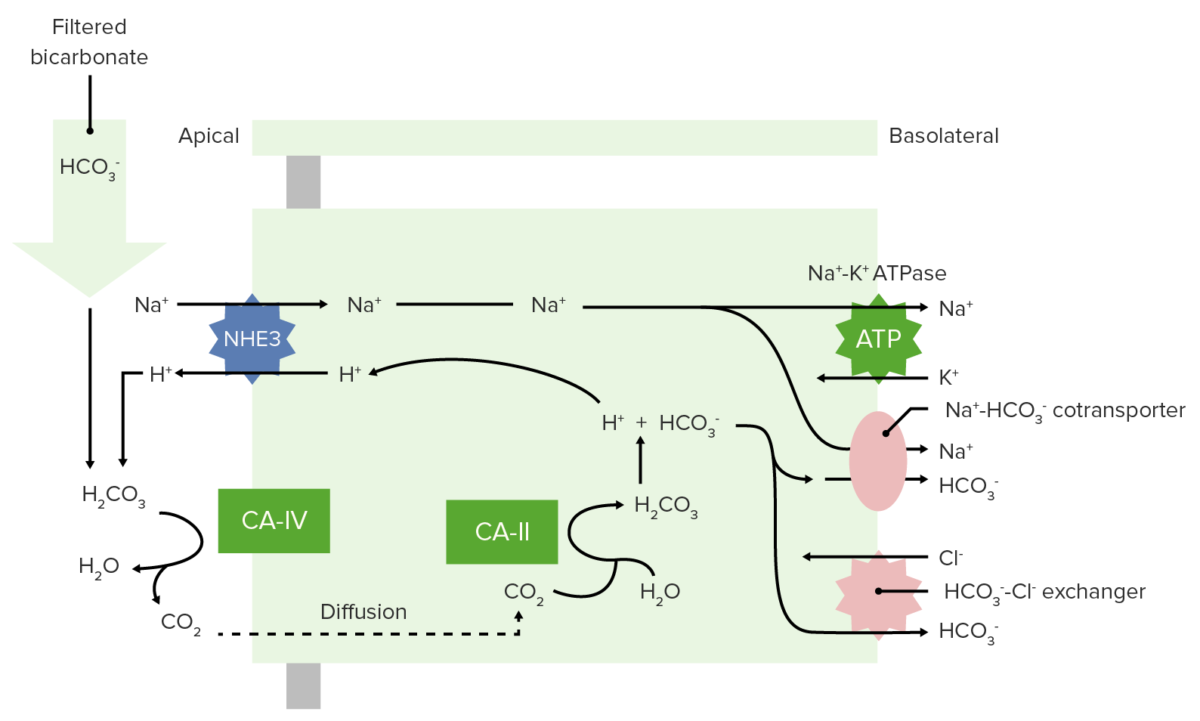
Reabsorción de bicarbonato en el túbulo proximal
CA-IV: anhidrasa carbónica IV
CA-II: anhidrasa carbónica II
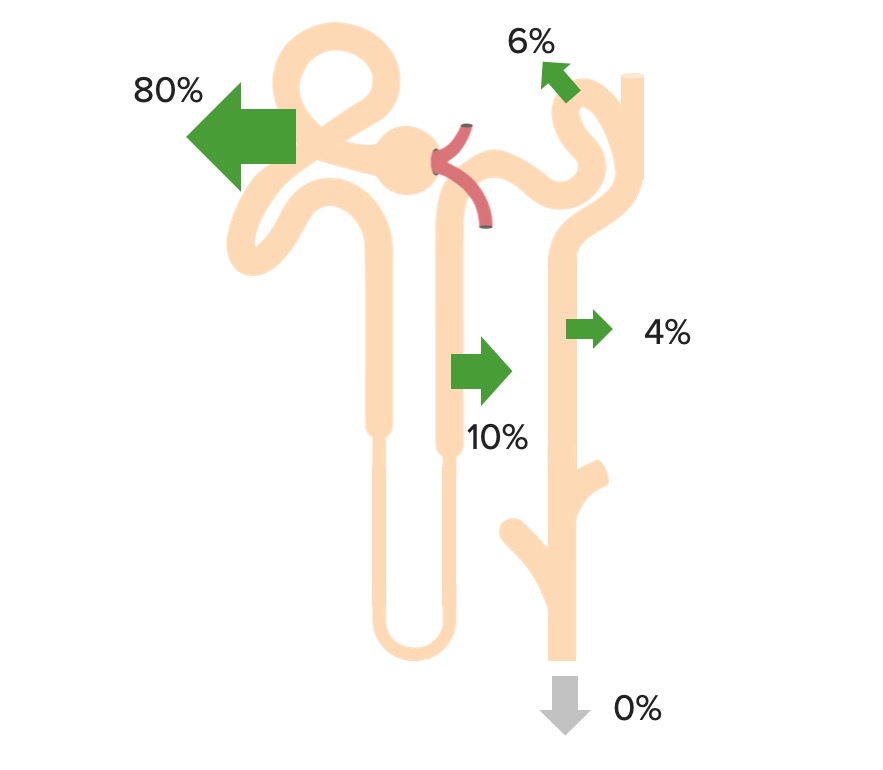
Reabsorción renal de HCO3–
Imagen por Lecturio.El NH3 puede ayudar a excretar ácidos fijos.
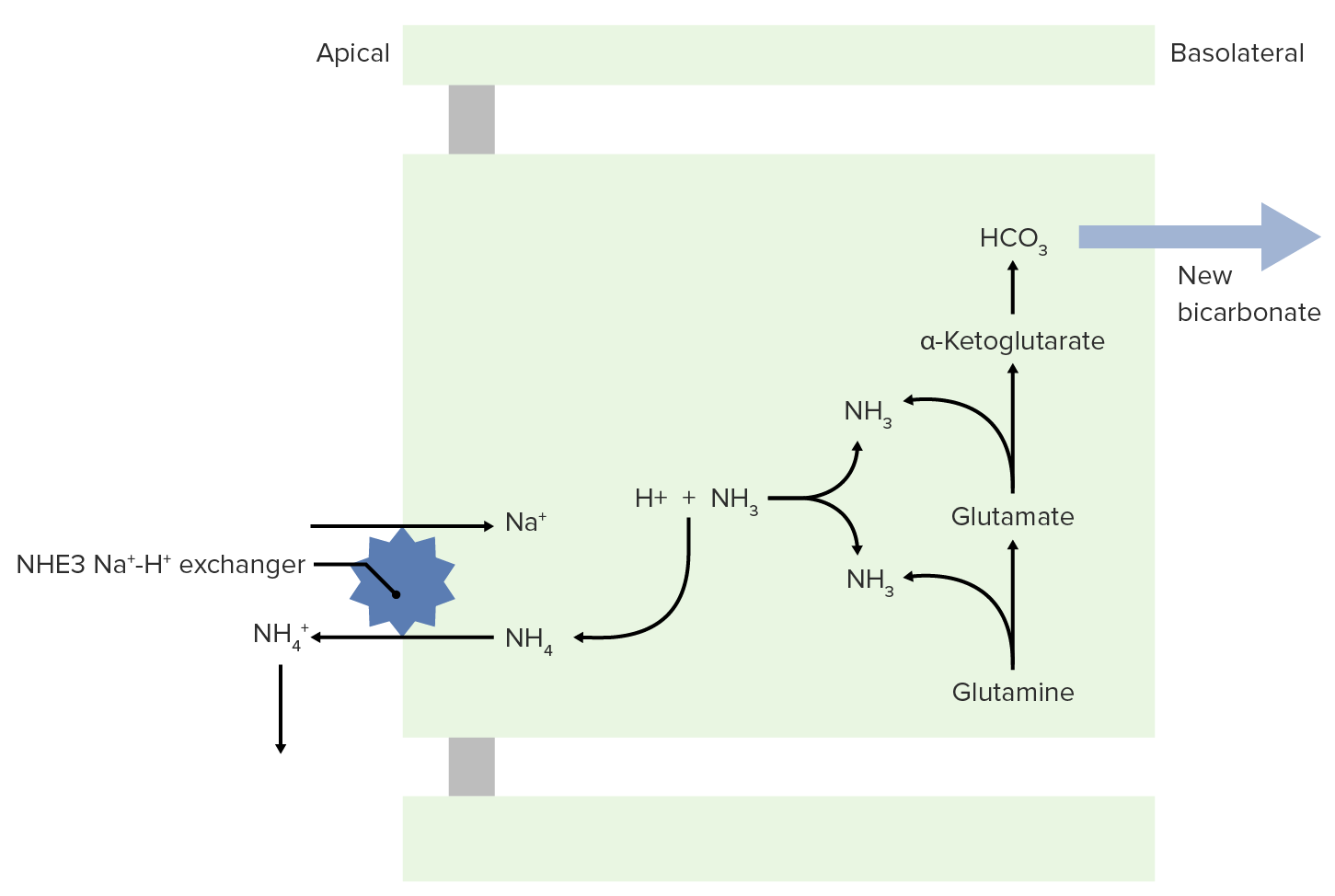
Transporte de NH3 y NH4+ a la luz para su excreción
Imagen por Lecturio.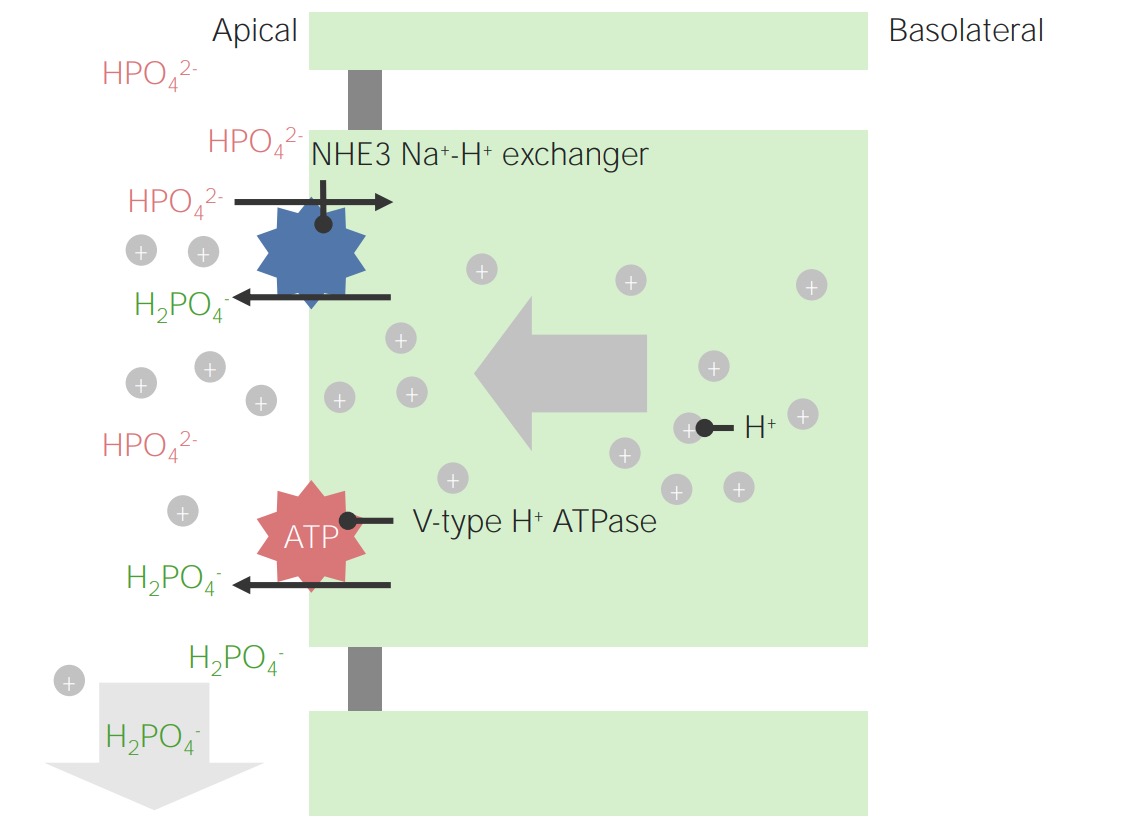
Ejemplo de fosfato como ácido titulable:
Tenga en cuenta que los iones de H+ intracelulares se originan a partir de la disociación de H2CO3. Este es también el mecanismo para la regeneración de HCO3–.
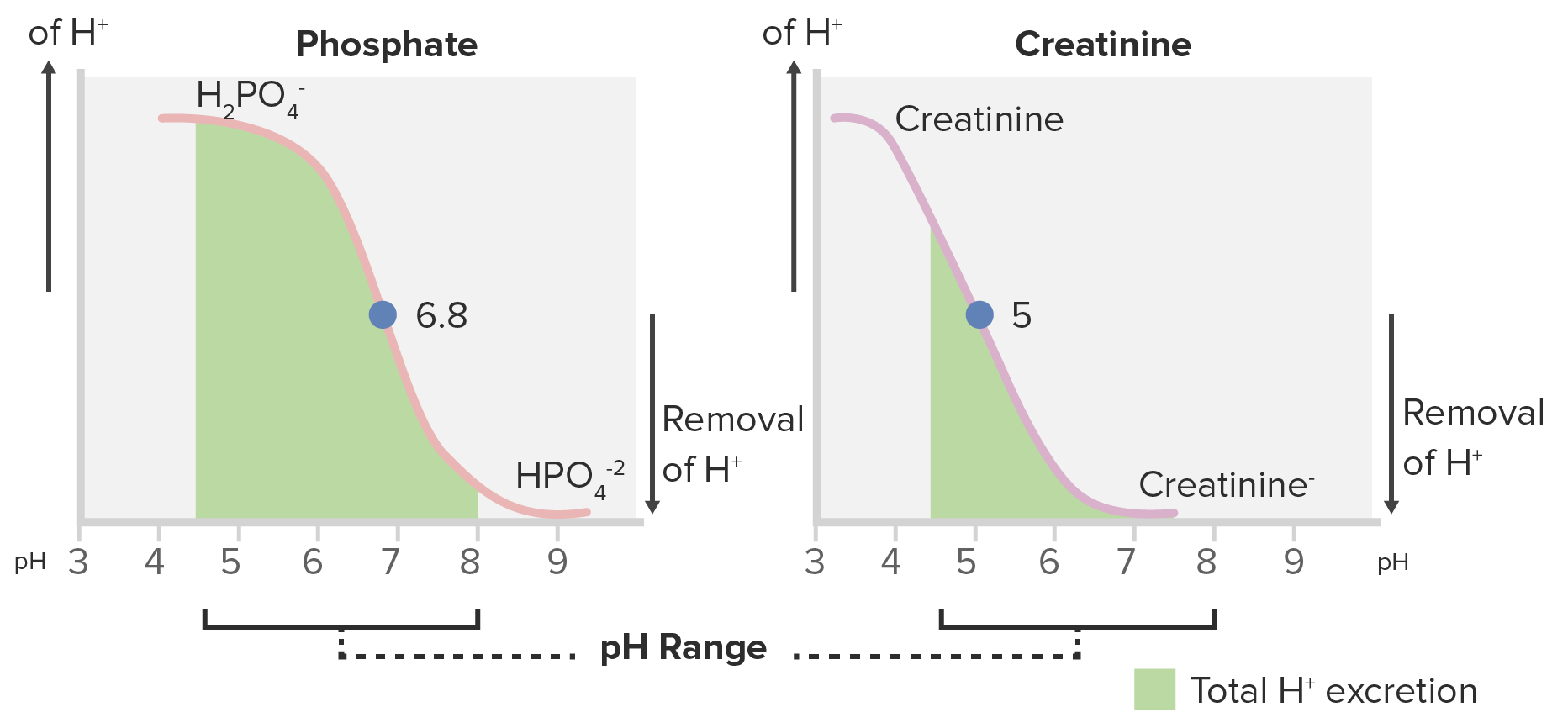
Curvas de titulación para fosfato y creatinina:
El fosfato es un ácido mejor valorable debido a su mayor área bajo la curva dentro del rango del pH normal de la orina (4,5–8).
Cuando un proceso patológico sobrepasa la capacidad normal de regular Regular Insulin el pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance, se producen los LOS Neisseria trastornos ácido-base primarios que se enumeran a continuación. También se producen mecanismos compensatorios que ayudan a compensar el cambio de pH pH The quantitative measurement of the acidity or basicity of a solution. Acid-Base Balance.