El dolor ha acompañado a los humanos desde que existieron por primera vez, primero lamentado como la maldición de la existencia y luego entendido como un mecanismo adaptativo que asegura la supervivencia. El dolor es la queja sintomática más común y la razón principal por la que las personas buscan atención médica. Los síntomas del dolor se ven todos los días, por todos los médicos, en todas las clínicas y hospitales del mundo. Comprender la fisiología del dolor es la piedra angular para comprender cómo tratarlo y brindarle al individuo su primer suspiro de alivio a medida que se emprende el tratamiento definitivo.
Última actualización: Feb 23, 2023
| Cambios fisiológicos | Dolor agudo | Dolor crónico |
|---|---|---|
| Signos vitales | Pueden variar consistentemente con el grado de severidad del dolor | Cambio nulo o mínimo |
| Propósito del dolor | Útil | Inhibe la función y no es útil |
| Sensibilización central | Corto plazo; mejora con la cicatrización de la herida | Permanece presente a pesar de la ausencia de una lesión en curso |
| Dolor neuropático | Aumenta la probabilidad de dolor crónico cuando está presente en la fase aguda | Etiología común del dolor crónico |
| Dolor nociceptivo | A menudo se encuentra durante el estado de dolor agudo | Comúnmente se presenta con algo de dolor neuropático |
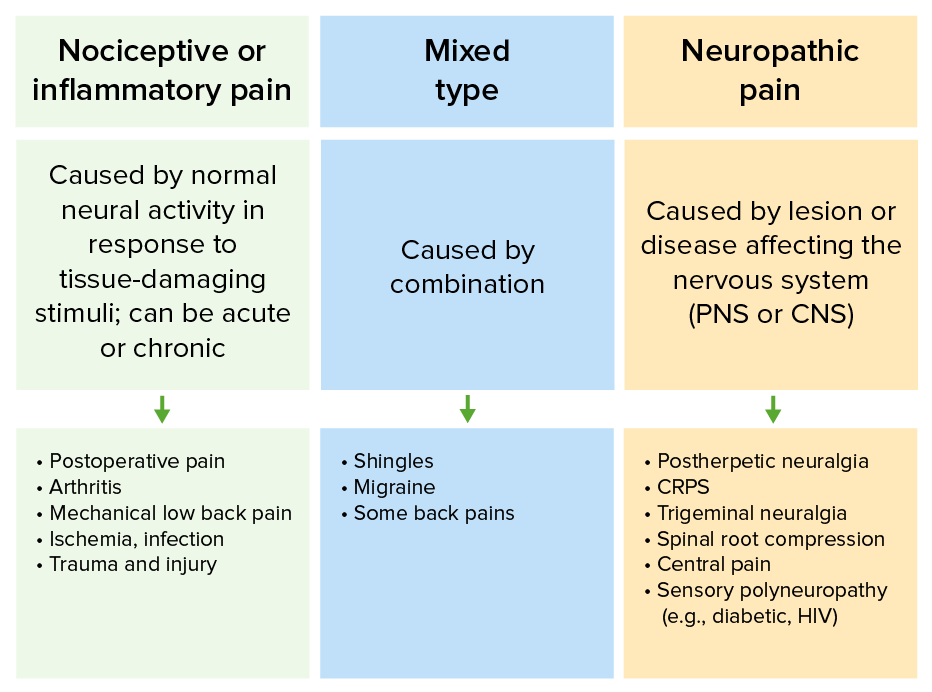
Diferencias en los tipos de dolor y sus etiologías comunes
CRPS: síndrome de dolor regional complejo
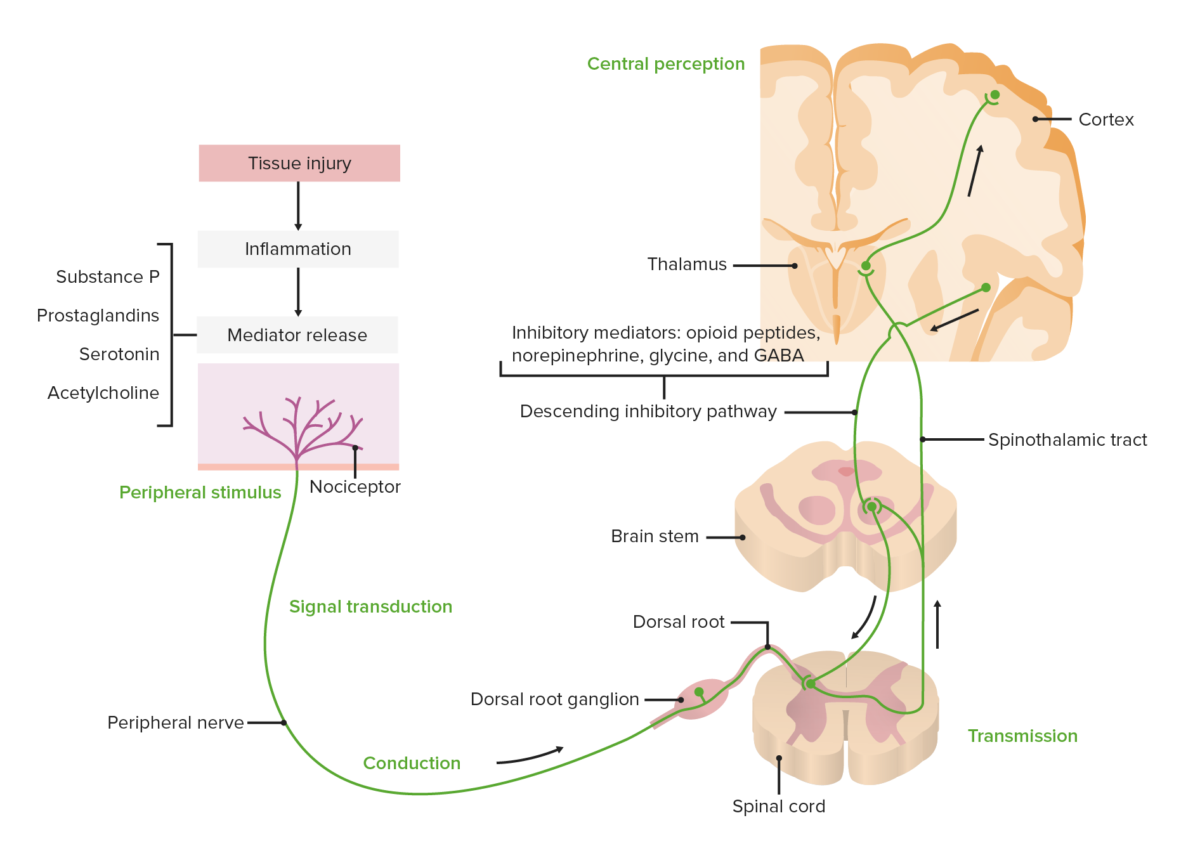
Diagrama que muestra la vía de transducción, transmisión, modulación y percepción central del dolor
Imagen por Lecturio.Fibras tipo A:
Fibras tipo B:
Fibras tipo C:
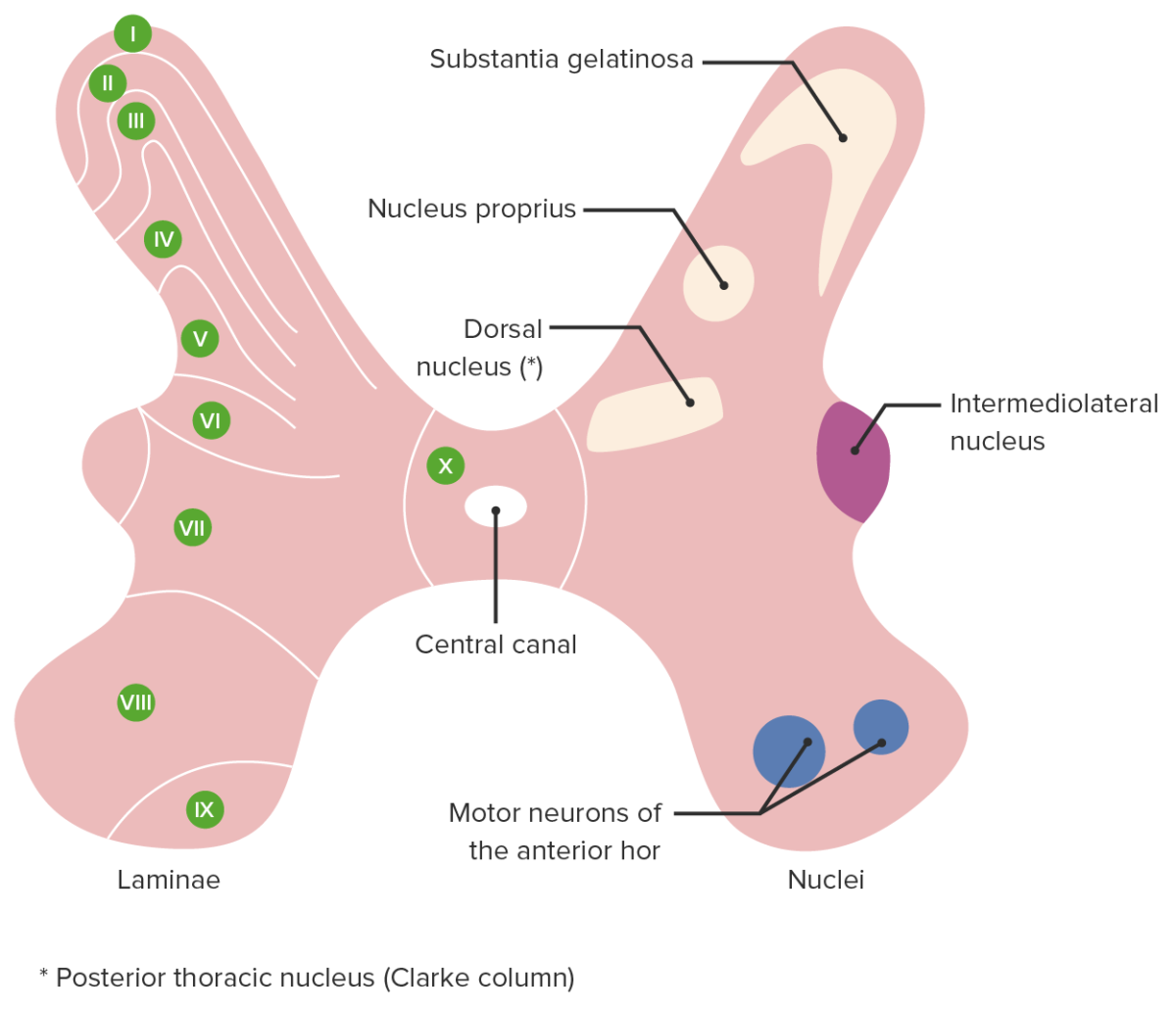
Sección transversal de la médula espinal que muestra las láminas rexed (izquierda) y los núcleos asociados (derecha)
Imagen por Lecturio.Vía ascendente del dolor:
Vía descendente del dolor:
El hipotálamo y las regiones corticales procesan estímulos dolorosos y envían señales para la liberación de hormonas y mediadores inhibidores (e.g., péptidos opioides, norepinefrina, glicina y ácido gamma aminobutirico) que hacen que la supresión del dolor sea más eficaz → modulación del dolor