La deficiencia del receptor de la interleucina-12 (IL-12) es una inmunodeficiencia primaria autosómica recesiva causada por una mutación en los genes que codifican los receptores de la IL-12 en las células T. La IL-12 promueve la inmunidad celular al inducir la maduración de las células T a células Th1 y estimular la secreción de interferón-gamma (IFN-γ). Este proceso, a su vez, activa las células asesinas naturales, los macrófagos y las células T citotóxicas. La deficiencia del receptor de IL-12 da lugar a un deterioro de todas estas funciones inmunológicas; en consecuencia, los pacientes presentan infecciones diseminadas.
Última actualización: Mar 28, 2025
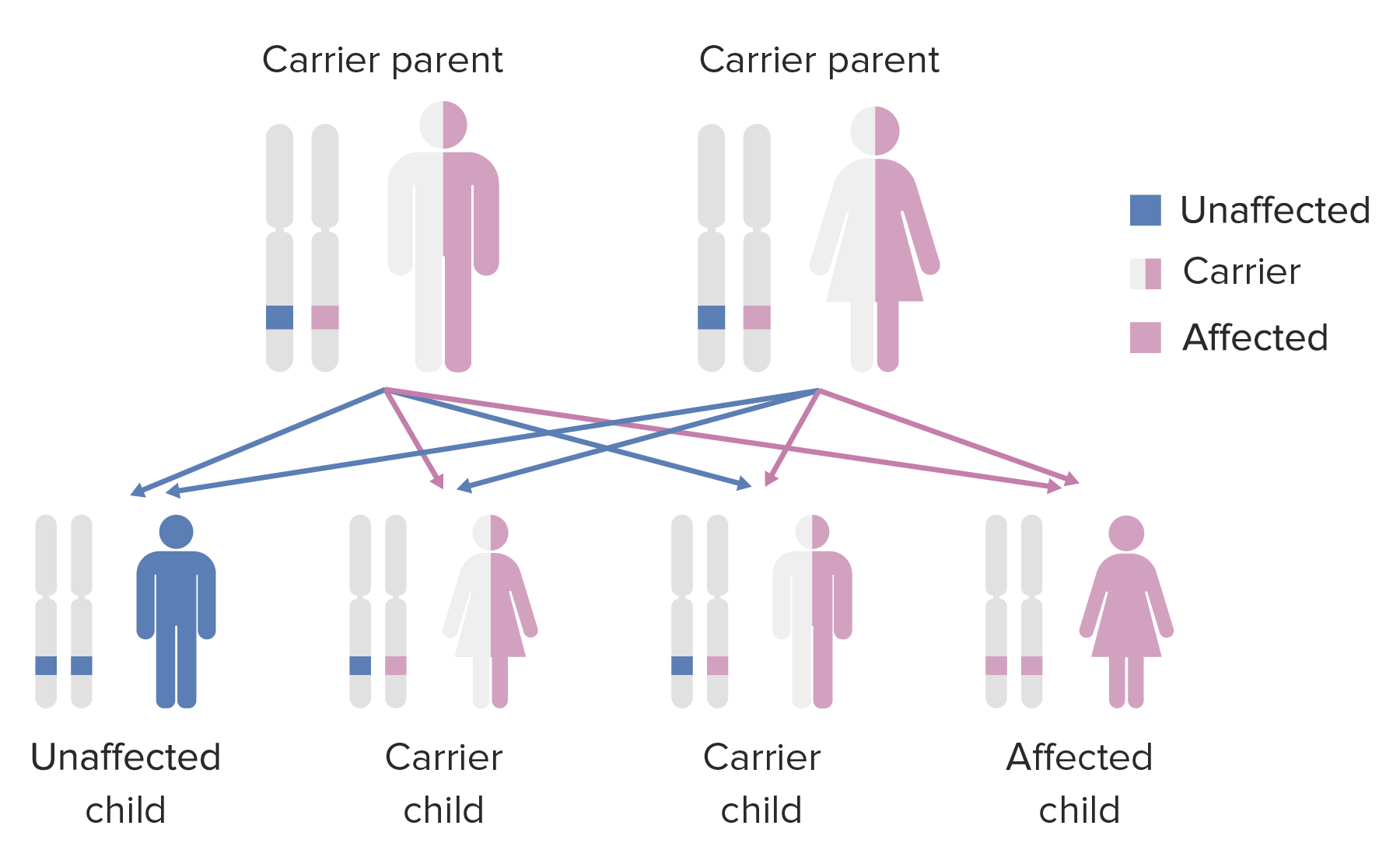
Herencia autosómica recesiva:
La descendencia afectada tendrá padres no afectados que son portadores.
Diagnóstico
Tratamiento
Las siguientes condiciones son diagnósticos diferenciales para la deficiencia del receptor de IL-12: