Los astrocitomas son tumores neuroepiteliales que surgen de los astrocitos, que son células gliales con forma de estrella. Según la clasificación CNS5 de la OMS, los astrocitomas se clasifican en astrocitomas pilocíticos (grado 1), astrocitomas difusos (grado 2), astrocitomas anaplásicos (grado 3) y glioblastomas (grado 4). Los tumores de grado 1 son benignos y se presentan en niños, mientras que el glioblastoma IDH de tipo salvaje es el tumor cerebral maligno primario más común en adultos y tiene un pronóstico desfavorable. La presentación clínica varía según la ubicación y el grado, pero a menudo incluye cefalea, convulsiones y déficits neurológicos focales. El diagnóstico requiere resonancia magnética combinada con análisis histopatológico y molecular del tejido de la biopsia, y el tratamiento depende del grado y el subtipo molecular del tumor, incluyendo cirugía, radioterapia y quimioterapia.
Última actualización: Jul 31, 2025
Los astrocitomas son tumores neuroepiteliales del SNC que surgen de los astrocitos, que son células gliales con forma de estrella.
| Categorías | Tumores específicos |
|---|---|
| Tumores neuroepiteliales (gliales y relacionados) |
|
| Tumores meníngeos | Meningiomas |
| Tumores vasculares | Hemangioblastomas |
| Tumores de la región selar |
|
| Tumores de la región pineal |
|
| Linfoma primario del SNC | Linfoma primario del SNC (generalmente de tipo difuso de células B grandes) |
| Tumores cerebrales metastásicos | Más comúnmente surgen de:
|
| Tumores del sistema nervioso periférico |
|
Según el sistema CNS 5 de la OMS, los astrocitomas se clasifican mediante un enfoque histológico y molecular integrado, y el grado tumoral (1-4) se determina por características como la atipia nuclear, la actividad mitótica, la proliferación microvascular y la necrosis.
La mayoría de las causas de los astrocitomas es desconocida. En última instancia, las mutaciones genéticas conducen a un crecimiento celular incontrolado y a la proliferación de tumores.
Hay varias mutaciones genéticas asociadas a los astrocitomas.
Los signos y síntomas neurológicos relacionados con los astrocitomas son el resultado de las perturbaciones de la función del SNC.
Los síntomas dependen principalmente de la localización del tumor en el cerebro. Los síntomas se dividen en 2 categorías:
La neuroimagen es esencial para la detección y la caracterización inicial, pero el diagnóstico definitivo y la gradación requieren histopatología y pruebas moleculares.
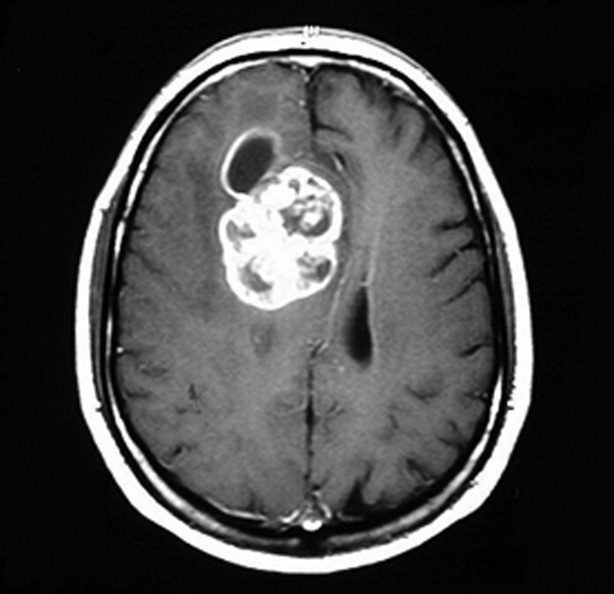
RM con contraste que muestra un glioblastoma multiforme
Imagen: “Glioblastoma multiforme” por Duncan JS, de Tisi J. Licencia: CC BY 3.0Se requiere tejido (mediante resección o biopsia estereotáctica) para la clasificación histopatológica y molecular. Una biopsia está indicada para la gradación o confirmación del diagnóstico tras la identificación del tumor mediante neuroimagen.

Astrocitoma pilocítico con células endoteliales prominentes así como células neoplásicas que albergan figuras mitóticas, núcleos blandos y ovalados
Imagen: “Hemorrhagic Pilocytic Astrocytomas in Adults: A Case Report and Literature Review” por Galgano MA, Padalino DJ, Fullmer J, Krishnamurthy S. Licencia: CC BY 3.0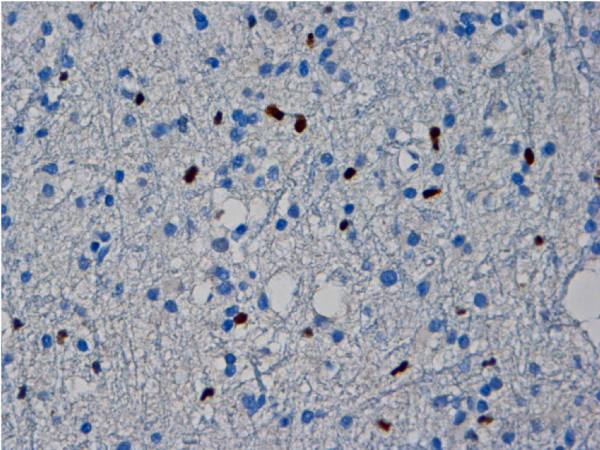
Imagen de una inmunotinción de la proteína de mantenimiento del minicromosoma 2 (MCM2, por sus siglas en inglés) de un astrocitoma de grado II positivo, con núcleos de células astrocíticas neoplásicas (oscuro) (objetivo 40×)
Imagen: “Expression and clinical significance of the proliferation marker minichromosome maintenance protein 2 (Mcm2) in diffuse astrocytomas WHO grade II” por Lind-Landström T, Varughese RK, Sundstrøm S, Torp SH., Licencia: CC BY 2.0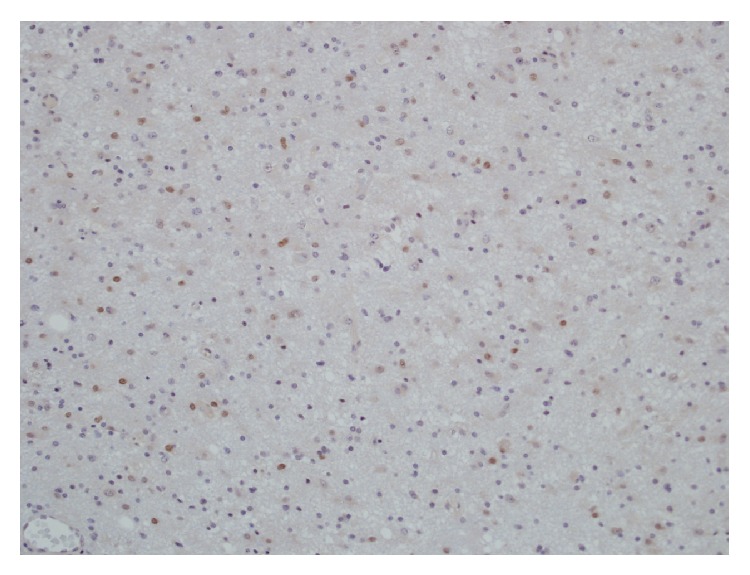
Microfotografía que demuestra una significativa inmunopositividad del p53 en un astrocitoma anaplásico
Imagen: “Malignant trigeminal nerve sheath tumor and anaplastic astrocytoma collision tumor with high proliferative activity and tumor suppressor p53 expression” por Kurdi M, Al-Ardati H, Baeesa SS. Licencia: Dominio Público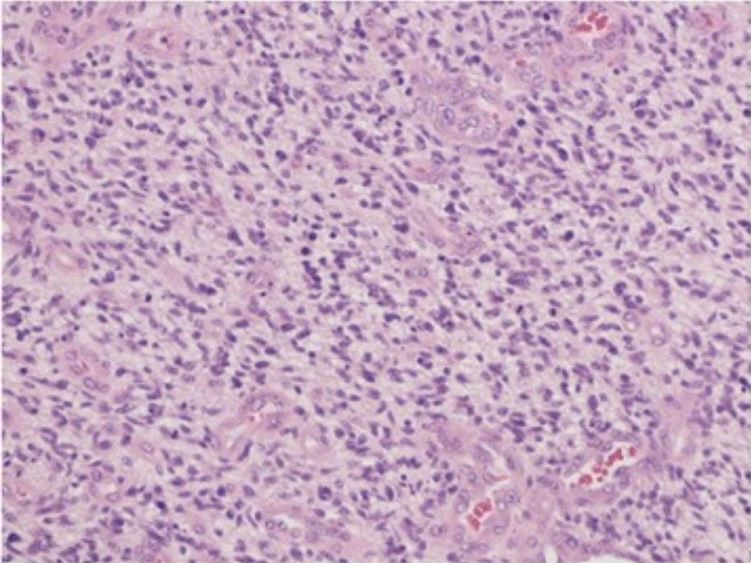
Microfotografía que revela una neoplasia glial celular altamente maligna, incrustada en un fondo glial fibrilar, con mitosis, proliferación endotelial y necrosis
Los hallazgos son consistentes con un glioblastoma (tinción de hematoxilina-eosina, ×40)
El tratamiento depende del grado, la localización del tumor (i.e., la cantidad que puede resecarse de manera segura) y los síntomas. El tratamiento suele consistir en una combinación de cirugía, radiación y quimioterapia.
Los factores que afectan al pronóstico son:
Cuando un paciente presenta síntomas neurológicos en la exploración, el diagnóstico diferencial puede incluir procesos vasculares (e.g., hemorragia, infarto), infecciones (e.g., absceso, encefalitis vírica) y procesos inflamatorios (e.g., esclerosis múltiple), además de tumores cerebrales primarios. El diagnóstico por imagenologia suele permitir reducir el diferencial a un tumor cerebral.