Los agentes antivirales contra los herpesvirus humanos (HHVs, por sus siglas en inglés) incluyen aciclovir, cidofovir y foscarnet. Los herpesvirus humanos son virus de ADN de la familia Herpesviridae . El virus del herpes simple (HSV, por sus siglas en inglés), el virus de la varicela-zoster (VZV, por sus siglas en inglés), el citomegalovirus (CMV), el virus de Epstein-Barr (EBV, por sus siglas en inglés) y el herpesvirus humano tipo 8 (HHV-8, por sus siglas en inglés) pertenecen a la familia Herpesviridae. Los antivirales contra esta familia generalmente actúan mediante la inhibición de la ADN polimerasa. El aciclovir (el análogo de nucleósido prototípico) requiere quinasa viral para la fosforilación a fin de convertirse en un trifosfato, que se incorpora en el ADN viral. El cidofovir requiere la fosforilación por parte de la cinasa celular del huésped, lo que permite que el cidofovir tenga actividad contra los virus mutados y se vuelva deficiente en la cinasa viral. Foscarnet (un análogo de pirofosfato) no requiere fosforilación. La nefrotoxicidad es un efecto secundario compartido entre los medicamentos. El aciclovir también puede causar nefropatía cristalina obstructiva y el foscarnet conlleva un riesgo de anomalías electrolíticas y convulsiones. El efecto nefrotóxico del cidofovir puede reducirse con solución salina intravenosa y probenecid.
Última actualización: May 11, 2022
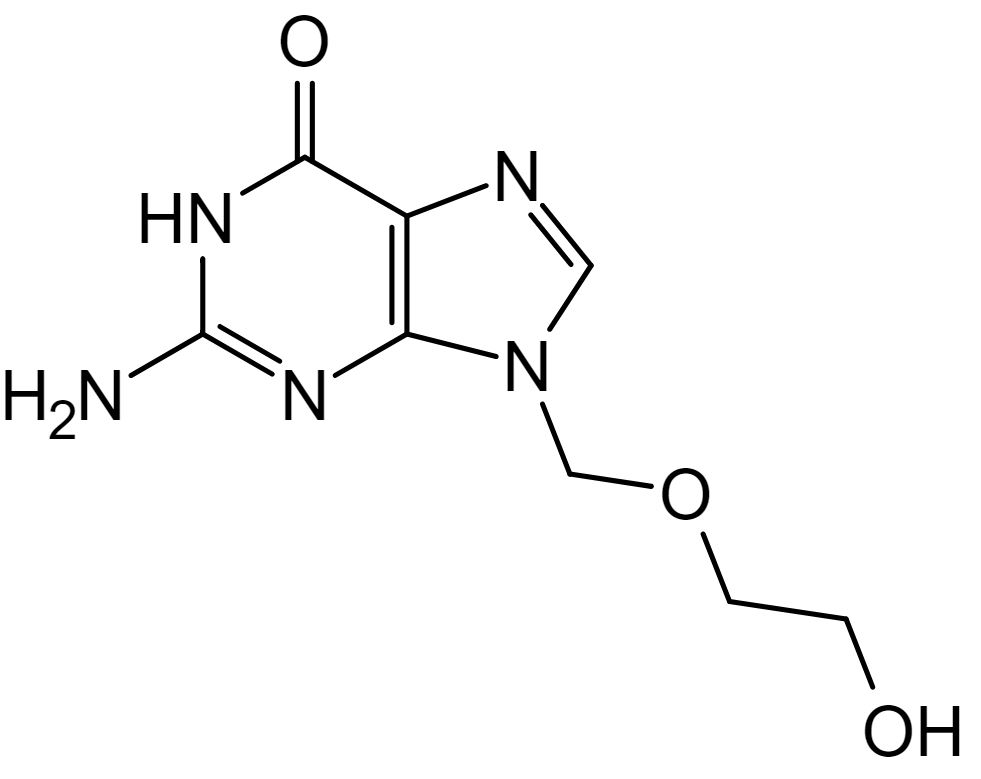
Estructura química del aciclovir
Imagen : “Aciclovir structure” por Steffen 962. Licencia: Dominio PúblicoAciclovir:
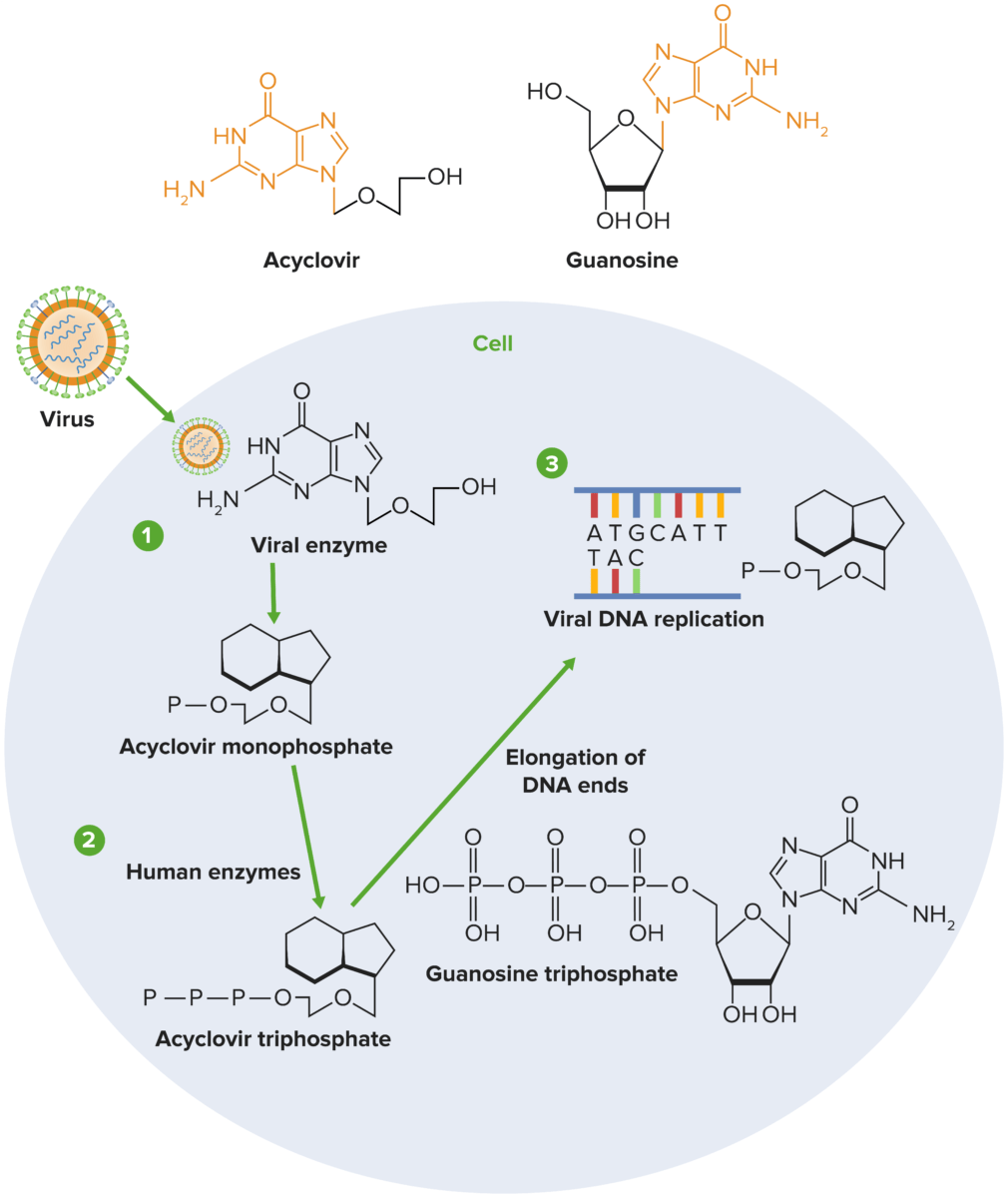
Mecanismo de acción del aciclovir:
1) El aciclovir sufre una fosforilación secuencial, facilitada por la timidina quinasa del herpesvirus y las quinasas del huésped. Dado que la timidina quinasa viral es necesaria para la fosforilación del aciclovir, solo las células infectadas por el virus se ven afectadas por el medicamento.
2) Las enzimas del huésped convierten el monofosfato en trifosfato de aciclovir, que posteriormente compite con el trifosfato de desguanosina (dGTP) por la ADN polimerasa viral.
3) El aciclovir se añade a la hebra en crecimiento durante la replicación viral en lugar del guanosintrifosfato (GTP), lo que detiene la replicación viral al detener la elongación de la molécula de ADN.
Aciclovir (y otros medicamentos relacionados):
Aciclovir:
| Medicamento | Características y mecanismo de acción | Farmacocinética | Indicación aprobada | Efectos secundarios de los medicamentos |
|---|---|---|---|---|
| Aciclovir |
|
Mala biodisponibilidad oral |
|
|
| Valaciclovir |
|
Buena biodisponibilidad oral | ||
| Penciclovir |
|
Tópica | HSV (herpes labial) | Efectos secundarios leves |
| Famciclovir |
|
Mejor biodisponibilidad oral que penciclovir |
|
|
| Ganciclovir |
|
|
Infecciones por citomegalovirus (CMV) |
|
| Valganciclovir |
|
Mejor biodisponibilidad oral que ganciclovir |
El cidofovir es un análogo de nucleótido de citidina.
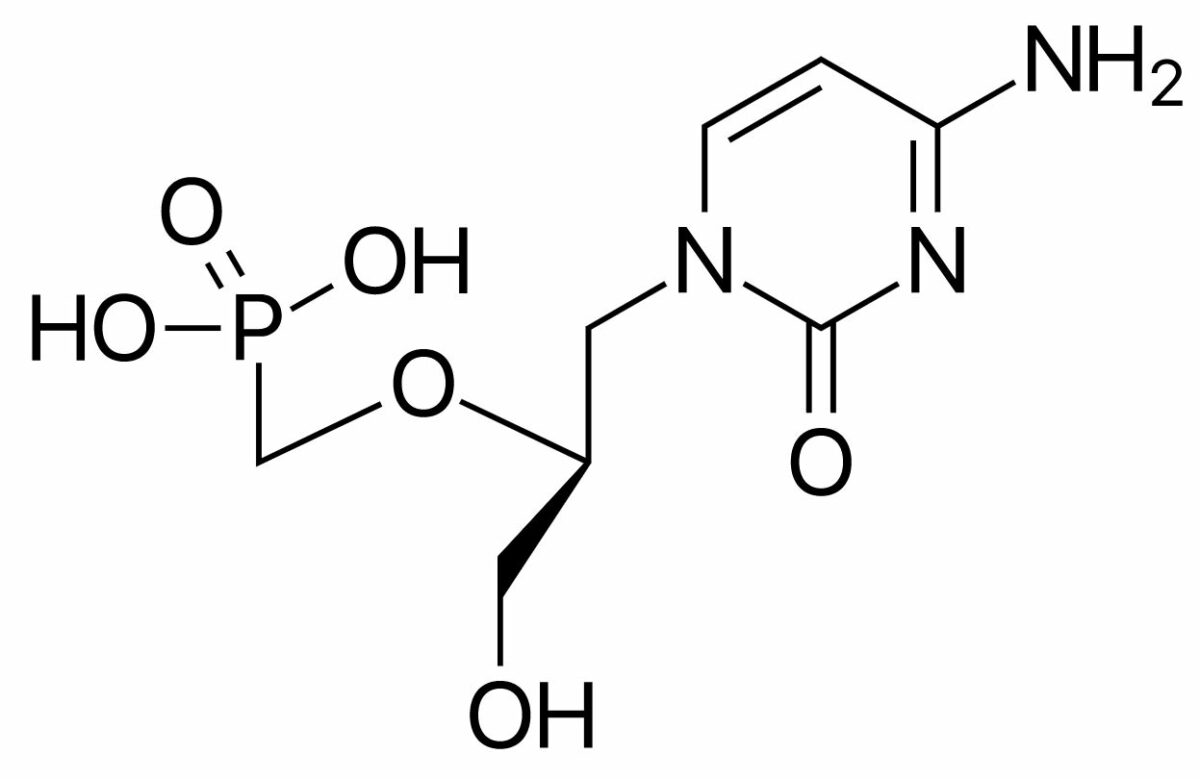
Estructura química del cidofovir
Imagen : “Cidofovir” por ljfa-ag. Licencia: Dominio PúblicoFoscarnet es un análogo de pirofosfato.
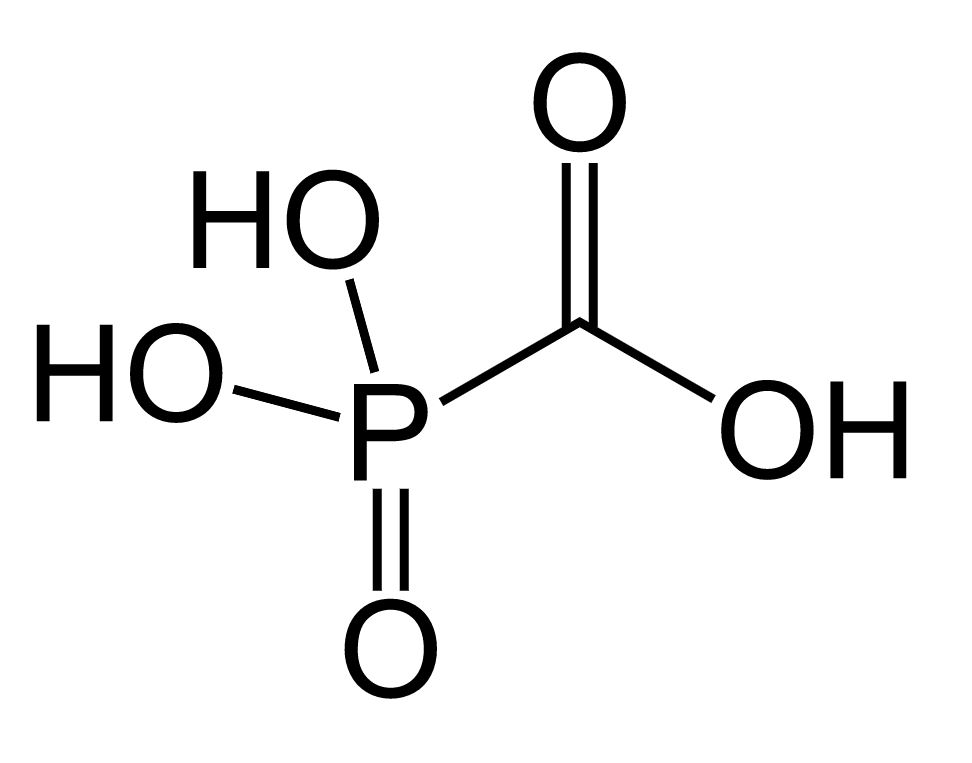
Estructura química de foscarnet
Imagen : “Foscarnet” por Fvasconcellos. Licencia: Dominio Público| Medicamento antiviral | Mecanismo de acción | Indicaciones | Principales efectos secundarios |
|---|---|---|---|
| Aciclovir (análogo de nucleósido) | Inhibidor de la polimerasa que requiere fosforilación por cinasa viral |
|
Lesión renal aguda (nefropatía obstructiva) |
| Cidofovir (análogo de nucleótido) | Inhibidor de la polimerasa que requiere fosforilación por la cinasa del huésped (no la cinasa viral) | Aprobado para retinitis por CMV con actividad contra otros virus* | Nefrotoxicidad (riesgo disminuido por solución salina IV y probenecid) |
| Foscarnet (análogo de pirofosfato) | Inhibidor de la polimerasa que no requiere fosforilación | Resistente a CMV y HSV |
|